
由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;
③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④③⑤① B.③②④①⑤ C.③④②⑤① D.②④⑤③①
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于化学反应的自发性叙述中正确的是 ( )
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A分子能形成二聚分子:2A(g)⇌A2 (g);△H<0.现欲测定A2分子的相对分子质量,应采取的措施是( )
|
| A. | 低温、高压 | B. | 低温、低压 | C. | 高温、低压 | D. | 高温、高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程需用到
哪些仪器,且先后顺序正确的是
①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④托盘天平 ⑤100 mL容量瓶
⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥ C.③⑤⑦⑥① D.④③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2 、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
A.4 mo1 B.5 mo1 C.6 mo1 D.7 mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
|
|
|
|
|
|
|
| |||||||
| |||||||
 | |||||||
|
(1)器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是(填名称) 。
(2)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是____________。
写出A经途径Ⅱ生成D的离子方程式 。
(3)从滤液E中硫酸得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备CuSO4溶液的化学方程式(要求节约,环保)
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.目前使用的元素周期表中,最长的周期含有36种元素.
B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”), ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时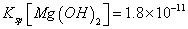 mol3
mol3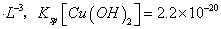 mol3.L-3).
mol3.L-3).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某同学对NaHSO4的物质类型进行的分析,其中不正确的是( )
A.根据元素组成可判断是化合物
B.因它电离会生成钠离子又符合盐的组成,故可属于钠盐
C.因它电离会生成硫酸根离子又符合盐的组成,故可属于硫酸盐
D. NaHSO4溶于水可电离出氢离子故可以称为酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com