
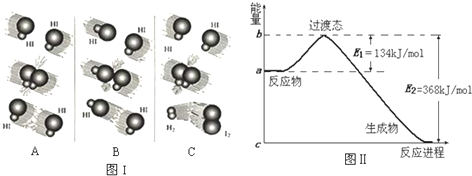
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
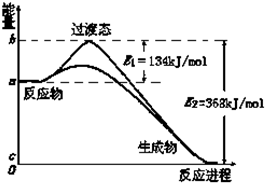 ;
;

 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
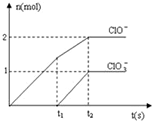 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、ClO
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、ClO- 3 |
- 3 |
| A、0~t1时,Ca(OH)2与Cl2发生反应的总化学方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O | ||
B、t2时,Cl-与ClO
| ||
| C、该石灰乳中含有Ca(OH)2的物质的量为10mol | ||
| D、由图可知,生成Ca(ClO3)2的反应是由温度升高引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
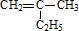 的键线式
的键线式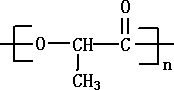 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为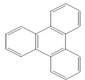 的一氯取代物有
的一氯取代物有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
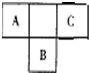 短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com