
| A. | 甲一定是强碱 | B. | 乙一定是弱碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |
分析 pH=12的碱溶液甲中c(OH-)=0.01mol/L,pH=11的碱溶液乙中c(OH-)=0.001mol/L,等体积的这两种溶液分别与等浓度的稀盐酸中和时,如果这两种种碱都是强碱,则消耗的盐酸体积前者是后者的10倍,实际上消耗盐酸的体积为2V甲=V乙,说明乙最终电离出的n(OH-)大于甲,据此分析解答.
解答 解:pH=12的碱溶液甲中c(OH-)=0.01mol/L,pH=11的碱溶液乙中c(OH-)=0.001mol/L,等体积的这两种溶液分别与等浓度的稀盐酸中和时,如果这两种种碱都是强碱,则消耗的盐酸体积前者是后者的10倍,实际上消耗盐酸的体积为2V甲=V乙,即此时乙消耗的盐酸多,说明乙最终电离出的n(OH-)大于甲,所以乙一定是弱碱,故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析推断能力,明确弱电解质电离特点并正确理解题给信息是解本题关键,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| B. | 相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,H2的燃烧热为571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,含1molNaOH的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
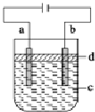
| A. | a电极的材料应为铁 | |
| B. | d为苯,其作用为防止空气中的O2把Fe(OH)2氧化 | |
| C. | 电解液c可以是NaCl溶液、NaOH溶液等 | |
| D. | 若电解过程中阳极消耗铁11.2g,理论上阴极产生气体为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
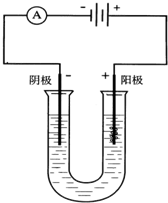 如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.
如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Y>Z,离子半径Z-<M2+ | |
| B. | MX2与水发生反应时,MX2只做氧化剂 | |
| C. | X、Y形成的化合物既能与强酸反应又能与强碱反应 | |
| D. | MX2、MZ2两种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解后溶液中c(H+)为2 mol•L-1 | B. | 上述电解过程中转移电子总数为NA | ||
| C. | 电解得到的Cu的物质的量为1 mol | D. | 原混合溶液中 c(K+)为5 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com