
| A. | ②④ | B. | ②③④ | C. | ②③ | D. | ①②③④ |
分析 如果硝酸不足量,则未被还原的硝酸为生成硝酸铁部分的硝酸;
如果硝酸过量,则FeS和FeO完全反应,被还原的硝酸为生成NO的硝酸,根据转移电子相等计算生成NO的硝酸量,根据N原子守恒计算未被还原的硝酸的量.
解答 解:如果硝酸不足量,则未被还原的硝酸为生成硝酸铁部分的硝酸,根据N、Fe原子守恒得n(HNO3)=3n[Fe(NO3)3]=3n(Fe)=3[n(FeS)+n(FeO)]=3×(a+b)mol=3(a+b)mol,m(HNO3)=n(HNO3).M(HNO3)=(a+b)×189g;
如果硝酸过量,则FeS和FeO完全反应,被还原的硝酸为生成NO的硝酸,根据转移电子相等、N原子守恒得生成NO的硝酸量=$\frac{amol×9+bmol×1}{5-2}$=$\frac{9a+b}{3}$mol,根据N原子守恒得未被还原的硝酸的量=Vcmol-$\frac{9a+b}{3}$mol=(Vc-$\frac{9a+b}{3}$)mol,
故选B.
点评 本题考查混合物的计算,侧重考查分析计算能力,根据原子守恒、转移电子守恒进行计算即可,注意要讨论解答,为易错题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ•mol-1 | |||||||||||
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g);△H=+566.0kJ/mol
| |||||||||||
| C. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6 kJ/mol | |||||||||||
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②③④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 材料 | 主要化学成分 | |
| A | 水泥 | 硅酸盐 |
| B | 光导纤维 | 二氧化硅 |
| C | 碳素钢 | 铁碳合金 |
| D | 漂白液 | 次氯酸钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.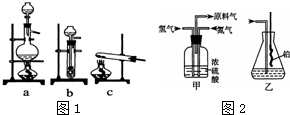
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;化合物BA4的电子式为
;化合物BA4的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期主族元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中零族元素的单质常温常压下全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大就越容易得电子 | |
| D. | 非金属元素的最低负价都和它的族序数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com