
| A.稀醋酸水溶液中 | B.氢氧化钙悬浊液中 |
| C.二氧化硫与氧气反应的混合物中 | D.稀氯化钠水溶液中 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.平衡常数随温度的改变而改变 |
B.对于密闭容器中反应2SO2+O2 2SO3,2体积SO2与足量O2反应,能生成2体积SO3 2SO3,2体积SO2与足量O2反应,能生成2体积SO3 |
| C.合成氨反应中使用催化剂,降低了反应所需要的活化能。 |
D.反应H2(g)+I2(g)  2HI(g) 在450℃时,其平衡常数为49;则反应 2HI(g) 在450℃时,其平衡常数为49;则反应 |
 1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7
1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是:
2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是: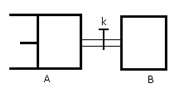
| A.反应开始时,B容器中化学反应速率快 |
| B.A容器中X的转化率为40%,且比B容器中X的转化率大 |
| C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计) |
| D.打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生成物的产量一定增大 | B.生成物的百分含量一定增大 |
| C.反应物的浓度一定降低 | D.每种反应物的转化率一定增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是| A.降温 | B.减压 | C.减少E的浓度 | D.加压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NH3(g)+3O2(g) △H =" a" kJ.mol-1
4NH3(g)+3O2(g) △H =" a" kJ.mol-1| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10—6mol) | 4.8 | 5.9 | 6.0 |
 g)
g)  3NH3(g) △H =" —92.4" kJ.mol-1
3NH3(g) △H =" —92.4" kJ.mol-1 2N2(g) + 6H2O(l)
2N2(g) + 6H2O(l)  4NH3(g) + 3O2(g)△H = _________。(3分)
4NH3(g) + 3O2(g)△H = _________。(3分)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| C.向氯水中加CaCO3后,溶液漂白性增强 |
| D.在硫化氢水溶液中加入碱有利于S2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)
CH3OH(g)
 不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。 u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com