
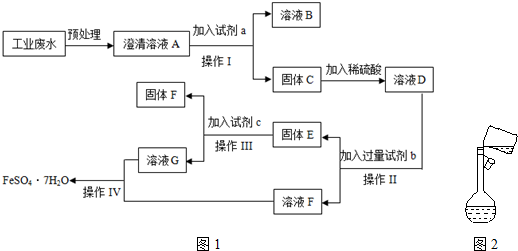
分析 工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4,从该废水中回收硫酸亚铁和金属铜,结合流程可知,试剂a为NaOH溶液,操作I为过滤,则B中主要含有硫酸钠,C中含有氢氧化铜和氢氧化亚铁或氢氧化铁,加入稀H2SO4,溶液D为硫酸铜、硫酸亚铁、硫酸铁的混合物,加入过量的铁粉,操作Ⅱ为过滤,得到E为Cu、Fe,溶液F中主要含FeSO4,Cu、Fe与试剂c为稀硫酸,得固体F为Cu,溶液G中含有FeSO4,从硫酸亚铁溶液中获得晶体,操作Ⅳ为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,以此来解答.
解答 解:工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4,从该废水中回收硫酸亚铁和金属铜,结合流程可知,试剂a为NaOH溶液,操作I为过滤,则B中主要含有硫酸钠,C中含有氢氧化铜和氢氧化亚铁或氢氧化铁,加入稀H2SO4,溶液D为硫酸铜、硫酸亚铁、硫酸铁的混合物,加入过量的铁粉,操作Ⅱ为过滤,得到E为Cu、Fe,溶液F中主要含FeSO4,Cu、Fe与试剂c为稀硫酸,得固体F为Cu,溶液G中含有FeSO4,从硫酸亚铁溶液中获得晶体,操作Ⅳ为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,
(1)操作Ⅰ、Ⅱ、Ⅲ均为过滤,所需玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(2)根据上面的分析可知,固体E的成分为 Fe和Cu,加入的试剂c为稀硫酸,故答案为:Fe和Cu;稀硫酸;
(3)试剂a为NaOH溶液,加入试剂a的目的是将溶液中的Fe2+和Cu2+转化为沉淀,便于与含有Na+的溶液分离,
故答案为:将溶液中的Fe2+和Cu2+转化为沉淀,便于与含有Na+的溶液分离;
(4)根据上面的分析可知,操作IV为蒸发浓缩、降温(冷却)结晶、过滤、洗涤、干燥,故答案为:降温(冷却)结晶;
(5)①配制500mL 0.40mol/L FeSO4溶液溶液时,进行的操作为计算、称量、溶解、转移、洗涤、定容、摇匀,所以操作顺序依次为 bjcefad,
故答案为:bjcefad;
②根据装置图可知,图中仪器的名称是烧杯和 500mL容量瓶,向容量瓶中转移溶液时应用玻璃棒引流,故答案为:500mL容量瓶;未用玻璃棒引流.
点评 本题考查混合物的分离、提纯,侧重分离流程和废水处理的考查,把握流程中发生的化学反应及分离方法为解答的关键,注重基础知识的考查,题目难度不大.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨 | |
| B. | 雷雨天,空气中的氮气转化为能被植物吸收的硝酸盐 | |
| C. | 用氨气与硝酸制成“硝铵”化肥 | |
| D. | 豆科作物的根瘤菌将空气中的氮转化为氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 75%的酒精溶液 | B. | 硝酸钠 | C. | 碱石灰 | D. | 豆浆 | ||||
| E. | 过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y、W的最高价含氧酸酸性顺序:Y>W>X | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | X、W形成的化合物XW4属于离子化合物 | |
| D. | 原子半径:Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c=$\frac{W1000ρ}{M}$ | B. | m=$\frac{VρW}{100}$ | C. | W%=$\frac{CM}{1000ρ}$% | D. | c=$\frac{1000m}{VM}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 该反应中Na2O2仅作氧化剂 | |
| C. | 4molNa2O2在反应中共得到8NA个电子 | |
| D. | Fe(OH)3是氧化产物,每生成1molO2反应过程中共转移6mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g二氧化硅晶体中含有2NA个硅氧键 | |
| B. | 1molD2O中含有10NA个质子 | |
| C. | 12g金刚石中含有NA个碳碳键 | |
| D. | 1mol石墨晶体中含有2NA个碳碳键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com