
ЁОЬтФПЁПГЃЮТЪБЃЌksp(CaC2O4)=2.4ЁС10-9ЃЌЯТСагаЙи0.10mol/LВнЫсФЦ(Na2C2O4)ШмвКЕФЫЕЗЈЃЌе§ШЗЕФЪЧ
A. ШмвКжаИїРызгХЈЖШДѓаЁЙиЯЕc(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+)
B. ШєЯђШмвКжаВЛЖЯМгЫЎЯЁЪЭЃЌШмвКжаИїРызгХЈЖШОљМѕаЁ
C. ШєгУpHМЦВтЕУДЫШмвКЕФpH=aЃЌдђH2C2O4ЕФЕкЖўМЖЕчРыЦНКтГЃЪ§дМЮЊKa2=1013-2a
D. ШєЯђИУШмвКжаМгШыЕШЬхЛ§CaCl2ШмвККѓФмЙЛВњЩњГСЕэЃЌдђCaCl2ШмвКЕФзюаЁХЈЖШгІИУДѓгк2.4ЁС10-8mol/L
ЁОД№АИЁПC
ЁОНтЮіЁПA. ШмвКжаC2O42-+H2O![]() HC2O4-+OH-ЃЌH2O
HC2O4-+OH-ЃЌH2O![]() H++OHЃЃЌРызгХЈЖШДѓаЁЙиЯЕc(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)ЃЌЙЪAДэЮѓЃЛB. ШєЯђШмвКжаВЛЖЯМгЫЎЯЁЪЭЃЌШмвКМюадМѕШѕЃЌc(OH-)МѕаЁЃЌЭЌЪБc(H+)діДѓЃЌЙЪBДэЮѓЃЛC. HC2O4-
H++OHЃЃЌРызгХЈЖШДѓаЁЙиЯЕc(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)ЃЌЙЪAДэЮѓЃЛB. ШєЯђШмвКжаВЛЖЯМгЫЎЯЁЪЭЃЌШмвКМюадМѕШѕЃЌc(OH-)МѕаЁЃЌЭЌЪБc(H+)діДѓЃЌЙЪBДэЮѓЃЛC. HC2O4-![]() H++C2O42-ЃЌKa2=c(H+)c(C2O42-)/c(HC2O4-)ЃЌ0.10mol/LNa2C2O4ШмвКжаC2O42-+H2O
H++C2O42-ЃЌKa2=c(H+)c(C2O42-)/c(HC2O4-)ЃЌ0.10mol/LNa2C2O4ШмвКжаC2O42-+H2O![]() HC2O4-+OH-ЃЌc(HC2O4-)Ёж c(OH-)ЃЌKa2Ёжc(H+)c(C2O42-)/c(OH-)= (H+)2c(C2O42-)/Kw=1013-2aЃЌЙЪCе§ШЗЃЛD. ШєЯђИУШмвКжаМгШыЕШЬхЛ§CaCl2ШмвККѓФмЙЛВњЩњГСЕэЃЌc(Ca2+)>ksp(CaC2O4)/c(C2O42-)=2.4ЁС10-9/0.10mol/L=2.4ЁС10-8mol/LЃЌдђCaCl2ШмвКЕФзюаЁХЈЖШгІИУДѓгк2ЁС2.4ЁС10-8mol/LМД4.8ЁС10-8mol/LЃЌЙЪDДэЮѓЁЃЙЪбЁCЁЃ
HC2O4-+OH-ЃЌc(HC2O4-)Ёж c(OH-)ЃЌKa2Ёжc(H+)c(C2O42-)/c(OH-)= (H+)2c(C2O42-)/Kw=1013-2aЃЌЙЪCе§ШЗЃЛD. ШєЯђИУШмвКжаМгШыЕШЬхЛ§CaCl2ШмвККѓФмЙЛВњЩњГСЕэЃЌc(Ca2+)>ksp(CaC2O4)/c(C2O42-)=2.4ЁС10-9/0.10mol/L=2.4ЁС10-8mol/LЃЌдђCaCl2ШмвКЕФзюаЁХЈЖШгІИУДѓгк2ЁС2.4ЁС10-8mol/LМД4.8ЁС10-8mol/LЃЌЙЪDДэЮѓЁЃЙЪбЁCЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиввЯЉЕФЫЕЗЈДэЮѓЕУЪЧ( )
A. ЦфВњСППЩКтСПЙњМвЕФЪЏгЭЛЏЙЄЗЂеЙЫЎЦНB. ВЛФмЪЙЫсадИпУЬЫсМиШмвКЭЪЩЋ
C. дкЙЄвЕжагУгкжЦзїОлввЯЉЫмСЯD. дкХЉвЕжазїжВЮяЩњГЄЕїНкМС
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІжаЃЌХЈСђЫсМШБэЯжГіЧПбѕЛЏадгжБэЯжГіЫсадЕФЪЧ( )
A. 2NaClЃЋH2SO4(ХЈ)![]() Na2SO4ЃЋ2HClЁќ
Na2SO4ЃЋ2HClЁќ
B. Na2SO3ЃЋH2SO4(ХЈ)![]() Na2SO4ЃЋSO2ЁќЃЋH2O
Na2SO4ЃЋSO2ЁќЃЋH2O
C. CЃЋ2H2SO4(ХЈ)![]() CO2ЁќЃЋ2SO2ЁќЃЋ2H2O
CO2ЁќЃЋ2SO2ЁќЃЋ2H2O
D. 2FeOЃЋ4H2SO4(ХЈ)![]() Fe2(SO4)3ЃЋSO2ЁќЃЋ4H2O
Fe2(SO4)3ЃЋSO2ЁќЃЋ4H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГєШЫсѕЅЕФЗжзгЪНЮЊC18H26O5,1molИУѕЅЭъШЋЫЎНтЕУЕН1molєШЫсКЭ2molввДМЃЌИУєШЫсЕФЗжзгЪНЮЊ
A. C16H22O5 B. C14H16O4 C. C16H20O4 D. C14H18O5
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПI2дкKIШмвКжаДцдкЯТСаЦНКтЃКI2ЃЈaqЃЉ+IЉЃЈaqЃЉ![]() I3ЉЃЈaqЃЉЃЌФГI2ЁЂKIЛьКЯШмвКжаЃЌcЃЈI3ЉЃЉгыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЃЈЧњЯпЩЯШЮКЮвЛЕуЖМБэЪОЦНКтзДЬЌЃЉЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
I3ЉЃЈaqЃЉЃЌФГI2ЁЂKIЛьКЯШмвКжаЃЌcЃЈI3ЉЃЉгыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЃЈЧњЯпЩЯШЮКЮвЛЕуЖМБэЪОЦНКтзДЬЌЃЉЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
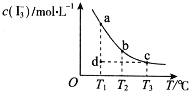
A. ЗДгІ I2ЃЈaqЃЉ+IЉЃЈaqЃЉ![]() I3ЉЃЈaqЃЉЁїHЃО0
I3ЉЃЈaqЃЉЁїHЃО0
B. ШєЮТЖШЮЊT1ЁЂT2ЃЌЗДгІЕФЦНКтГЃЪ§ЗжБ№ЮЊK1ЁЂK2ЃЌдђK2ЃОK1
C. ШєT1ЪБЃЌЗДгІНјааЕНзДЬЌdЪБЃЌвЛЖЈгаІде§ЃОІдФц
D. зДЬЌaгызДЬЌbЯрБШЃЌзДЬЌbЪБI2ЕФзЊЛЏТЪИќИп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФІАнЕЅГЕРћгУГЕРКДІЕФЬЋбєФмЕчГиАхЯђжЧФмЫјжаЕФяЎРызгЕчГиГфЕчЃЌЕчГиЗДгІдРэЮЊLiCoO2 +6C![]() li1-xCoO2 +lixC6ЃЌНсЙЙШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
li1-xCoO2 +lixC6ЃЌНсЙЙШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
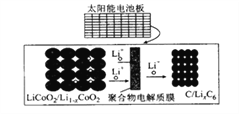
A. ЗХЕчЪБЃЌе§МЋжЪСПдіМг
B. ГфЕчЪБЃЌяЎРызггЩгвЯђзѓвЦЖЏ
C. ИУМиРыСЫЕчГиЙЄзїЪБЃЌЩцМАЕНЕФФмСПаЮЪНга3 жж
D. ГфЕчЪБЁЂбєМЋЕФЕчМЋЗДгІЪНЮЊLi1-xCoO2+xLi++xe-= LiCoO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПюмЃЈCoЃЉМАЦфЛЏКЯЮядкЙЄвЕЩЯгаЙуЗКгІгУЁЃЮЊДгФГЙЄвЕЗЯСЯжаЛиЪеюм,ФГбЇЩњЩшМЦСїГЬШчЯТЃЈЗЯСЯжаКЌгаAlЁЂLiЁЂCo2O3КЭFe2O3ЕШЮяжЪЃЉЁЃ

вбжЊ:ЂйЮяжЪШмНтад:LiFФбШмгкЫЎ,Li2CO3ЮЂШмгкЫЎ;
ЂкВПЗжН№ЪєРызгаЮГЩЧтбѕЛЏЮяГСЕэЕФpHМћЯТБэЁЃ
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(ПЊЪМГСЕэ) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(ЭъШЋГСЕэ) | 3.2 | 9.15 | 1.09 | 4.7 |
ЧыЛиД№:
ЃЈ1ЃЉВНжшЂёжаЕУЕНКЌТСШмвКЕФЗДгІЕФРызгЗНГЬЪНЪЧ__________ЁЃ
ЃЈ2ЃЉаДГіВНжшЂђжаCo2O3гыбЮЫсЗДгІЩњГЩCl2ЕФРызгЗНГЬЪН:______ЁЃ
ЃЈ3ЃЉВНжшЂѓжаNa2CO3ШмвКЕФзїгУЪЧЕїНкШмвКЕФpH,гІЪЙШмвКЕФpHВЛГЌЙ§______;ЗЯдќжаЕФжївЊГЩЗжГ§СЫLiFЭт,ЛЙга______ЁЃ
ЃЈ4ЃЉNaFгыШмвКжаЕФLi+аЮГЩLiFГСЕэ,ДЫЗДгІЖдВНжшЂєЫљЦ№ЕФзїгУЪЧ______ЁЃ
ЃЈ5ЃЉдкПеЦјжаМгШШ5.49 gВнЫсюмОЇЬхЃЈCoC2O4ЁЄ2H2OЃЉбљЦЗ,ЪмШШЙ§ГЬжаВЛЭЌЮТЖШЗЖЮЇФкЗжБ№ЕУЕНвЛжжЙЬЬхЮяжЪ,ЦфжЪСПШчБэЁЃ
ЮТЖШЗЖЮЇ/Ёц | ЙЬЬхжЪСП/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
ЂйМгШШЕН210 ЁцЪБ,ЙЬЬхжЪСПМѕЧсЕФдвђЪЧ__________ЁЃ
ЂкОВтЖЈ,МгШШЕН210~290 ЁцЙ§ГЬжаЕФЩњГЩЮяжЛгаCO2КЭюмЕФбѕЛЏЮяspan>,ДЫЙ§ГЬЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________ЁЃ[вбжЊM(CoC2O4ЁЄ2H2O)=183 gЁЄmol-1]
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгЩКЌЭЗЯСЯжЦЭЕФвЛжжЗНАИЪЧЃК

ЃЈ1ЃЉаДГіЯТСаВНжшжаЕФЛЏбЇЗНГЬЪНЃКВНжшЂѓЃК_________ЃЎВНжшVЃК_________ЃЎ
ЃЈ2ЃЉВНжшЂђКѓаЮГЩЕФРЖЩЋШмвКжаЕФШмжЪЪЧ_________ЃЎ
ЃЈ3ЃЉЩЯЪіЗНАИжаПЩФмдьГЩПеЦјЮлШОЕФВНжшЪЧ_________ЃЎ
ЃЈ4ЃЉШєКЌЭЗЯСЯЕФжЪСПЮЊaЧЇПЫЃЌКкЩЋЗлФЉЕФжЪСПbЧЇПЫЃЌдђИУКЌЭЗЯСЯжаЕФКЌЭСПЮЊЃК___________ЃЈгУКЌa,bЕФДњЪ§ЪНБэЪОЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ25 ЁцЪБ,ВПЗжШѕЕчНтжЪЕФЕчРыЦНКтГЃЪ§Ъ§ОнШчЯТБэЃК
ШѕЫсЛЏбЇЪН | CH3COOH | HCN | H2CO3 |
ЕчРыЦНКтГЃЪ§ | 1.7ЁС10Ѓ5 | 6.2ЁС10Ѓ10 | K1ЃН4.3ЁС10Ѓ7 K2ЃН5.6ЁС10Ѓ11 |
ЃЈ1ЃЉгУРызгЗНГЬЪНБэЪОNa2CO3ШмвКГЪМюадЕФдвђЃК____________________ЁЃ
ЃЈ2ЃЉЕШЮяжЪЕФСПХЈЖШЕФAЃЎCH3COONa BЃЎNaCN CЃЎNa2CO3 DЃЎNaHCO3ШмвКЕФpHгЩДѓЕНаЁЕФЫГађЮЊ____________________________________(ЬюзжФИ)ЁЃ
ЃЈ3ЃЉвбжЊдк25ЁцЪБ, НЋHCNШмвКгыNaOHШмвКЕШЬхЛ§ЕШХЈЖШЛьКЯКѓ,ДЫШмвКжаРызгХЈЖШгЩДѓЕНаЁЕФЫГађЪЧ____________________________________ЁЃ
ЃЈ4ЃЉГЃЮТЯТЃЌ0.1molЁЄLЃ1ЕФCH3COOHШмвКМгЫЎЯЁЪЭЃЌЯТСаБэДяЪНЕФЪ§ОнБфДѓЕФЪЧ______ЁЃ
AЃЎc(HЃЋ) BЃЎc(HЃЋ)/c(CH3COOH) CЃЎc(HЃЋ)ЁЄc(OHЃ)
ЃЈ5ЃЉЬхЛ§ОљЮЊ10 mL ,pHОљЮЊ2ЕФДзЫсШмвКгыбЮЫсЗжБ№гызуСПZnЗДгІЃЌЗДгІИеПЊЪМЪБВњЩњH2ЕФЫйТЪЃКv(HCl)______v(CH3COOH)ЃЈЬюЁАЃНЁБЁЂЁАЃОЁБЛђЁАЃМЁБЯТЭЌЃЉЃЌЗДгІЭъШЋКѓЃЌЫљЕУЧтЦјЕФжЪСПЃКm(H2)бЮЫс_______m(H2)ДзЫсЁЃ
ЁОД№АИЁП CO32-+H2O HCO3-+OH- C>B>D>A c(Na+)>c(CN-)>c(OH-)>c(H+) B = <
ЁОНтЮіЁПЃЈ1ЃЉ. Na2CO3ЪЧЧПМюШѕЫсбЮЃЌЬМЫсИљРызгЗЂЩњЫЎНтЃКCO32-+H2O HCO3-+OH-ЃЌЪЙШмвКГЪМюадЃЌЙЪД№АИЮЊЃКCO32-+H2O HCO3-+OH-ЃЛ
ЃЈ2ЃЉ.гЩБэжаЪ§ОнПЩжЊЃЌЫсадЧПШѕЫГађЮЊЃКCH3COOH> H2CO3> HCN>HCO3ЃЃЌИљОндНШѕдНЫЎНтЕФЙцТЩПЩжЊЃЌРызгЕФЫЎНтГЬЖШЃКCO32Ѓ>CNЃ>HCO3Ѓ>CH3COOЃЃЌдђЕШЮяжЪЕФСПХЈЖШЕФAЃЎCH3COONa BЃЎNaCN CЃЎNa2CO3 DЃЎNaHCO3ЫФжжШмвКЕФpHгЩДѓЕНаЁЕФЫГађЮЊЃКC>B>D>AЃЌЙЪД№АИЮЊЃКC>B>D>AЃЛ
ЃЈ3ЃЉ.дк25ЁцЪБЃЌНЋHCNШмвКгыNaOHШмвКЕШЬхЛ§ЕШХЈЖШЛьКЯКѓЃЌЖўепЧЁКУЭъШЋЗДгІЃЌЕУЕНNaCNШмвКЃЌвђNaЃЋВЛЫЎНтЖјCNЃЫЎНтЃЌЫљвдc(NaЃЋ)ЃОc(CNЃ)ЃЌCNЃЫЎНтЪЙШмвКГЪМюадЃЌдђc(OH-)>c(H+)ЃЌвђбЮЕФЫЎНтЗДгІЪЧЮЂШѕЕФЃЌдђc(CN-)>c(OH-)ЃЌЫљвдДЫШмвКжаРызгХЈЖШгЩДѓЕНаЁЕФЫГађЪЧЃКc(Na+)>c(CN-)>c(OH-)>c(H+)ЃЌЙЪД№АИЮЊЃКc(Na+)>c(CN-)>c(OH-)>c(H+)ЃЛ
ЃЈ4ЃЉ.A.ГЃЮТЯТЃЌ0.1 molЁЄLЃ1ЕФCH3COOH ШмвКМгЫЎЯЁЪЭЃЌДйНјДзЫсЕФЕчРыЃЌЪЙДзЫсЕчРыЦНКте§ЯђвЦЖЏЃЌnЃЈH+ЃЉдіДѓЃЌЕЋcЃЈH+ЃЉКЭcЃЈCH3COOЃЃЉМѕаЁЃЌЙЪAДэЮѓЃЛB. ИљОнKa=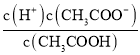 ПЩжЊЃЌ
ПЩжЊЃЌ  =
=  ЃЌИљОнAЯюЗжЮіПЩжЊЃЌcЃЈCH3COOЃЃЉМѕаЁЃЌвђЮТЖШВЛБфЃЌдђKaВЛБфЃЌЙЪ
ЃЌИљОнAЯюЗжЮіПЩжЊЃЌcЃЈCH3COOЃЃЉМѕаЁЃЌвђЮТЖШВЛБфЃЌдђKaВЛБфЃЌЙЪ =
=  діДѓЃЌЙЪBе§ШЗЃЛC. c(HЃЋ)ЁЄc(OHЃ)= KwЃЌвђЮТЖШВЛБфЃЌдђKwВЛБфЃЌЙЪc(HЃЋ)ЁЄc(OHЃ)вВВЛБфЃЌЙЪCДэЮѓЃЛД№АИбЁBЃЛ
діДѓЃЌЙЪBе§ШЗЃЛC. c(HЃЋ)ЁЄc(OHЃ)= KwЃЌвђЮТЖШВЛБфЃЌдђKwВЛБфЃЌЙЪc(HЃЋ)ЁЄc(OHЃ)вВВЛБфЃЌЙЪCДэЮѓЃЛД№АИбЁBЃЛ
ЃЈ5ЃЉ.pHЯрЭЌЕФВЛЭЌДзЫсКЭбЮЫсжаЃЌЧтРызгХЈЖШЯрЭЌЃЌЗДгІИеПЊЪМЪБЃЌгыZnЗДгІЫйТЪЕФЯрЭЌЃЛвђДзЫсЪЧШѕЫсЃЌДзЫсжаЫсЕФХЈЖШДѓгкЧтРызгХЈЖШЃЌбЮЫсжаЫсЕФХЈЖШЕШгкЧтРызгХЈЖШЃЌЫљвдДзЫсЕФХЈЖШДѓгкHClЕФХЈЖШЃЌдђЫљЕУЧтЦјЕФжЪСПЃКmЃЈH2ЃЉбЮЫс<mЃЈH2ЃЉДзЫсЃЌЙЪД№АИЮЊЃК=ЃЛЃМЁЃ
ЕуОІЃКБОЬтжївЊПМВщШѕЕчНтжЪЕФЕчРыЦНКтКЭШмвКжаЮЂСЃХЈЖШЕФДѓаЁБШНЯЃЌЬтФПФбЖШВЛДѓЁЃБОЬтЕФвзДэЕуЪЧЕкЃЈ4ЃЉаЁЮЪЃЌЗжЮіЪБМШвЊНсКЯЦНКтвЦЖЏдРэЃЌвВвЊЩЦгкРћгУЦНКтГЃЪ§жЛгыЮТЖШгаЙиНјааХаЖЯЃЌШчБШНЯc(HЃЋ)/c(CH3COOH)ЪБЃЌПЩвдИљОнKa= ЕУГіЃК
ЕУГіЃК  =
= 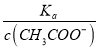 ЃЌдйИљОнcЃЈCH3COOЃЃЉМѕаЁЃЌвђЮТЖШВЛБфЃЌдђKaВЛБфЃЌЙЪ
ЃЌдйИљОнcЃЈCH3COOЃЃЉМѕаЁЃЌвђЮТЖШВЛБфЃЌдђKaВЛБфЃЌЙЪ =
=  діДѓЃЌПЩвдПьЫйНтОіДЫРрЮЪЬтЁЃ
діДѓЃЌПЩвдПьЫйНтОіДЫРрЮЪЬтЁЃ
ЁОЬтаЭЁПзлКЯЬт
ЁОНсЪјЁП
25
ЁОЬтФПЁПбЮЫсКЭЧтбѕЛЏФЦЪЧЙЄвЕЩЯживЊЕФЛЏЙЄдСЯЃЌвВЪЧЪЕбщЪвРяГЃМћЕФЛЏбЇЪдМСЁЃ
ЂёЃЎВтЖЈжаКЭШШЃЎ
ЃЈ1ЃЉаДГіЯЁбЮЫсКЭЯЁЧтбѕЛЏФЦШмвКЗДгІБэЪОжаКЭШШЕФШШЛЏбЇЗНГЬЪН__________ЃЈжаКЭШШЪ§жЕЮЊ57.3kJ/molЃЉЁЃ
ЃЈ2ЃЉШЁ50mL 0.5mol/L HClШмвКгы50mL0.55mol/L NaOHШмвКНјааВтЖЈЃЌЕЋЪЕбщЪ§жЕаЁгк57.3kJ/molЃЌдвђВЛПЩФмЪЧ_______ЃЈЬюађКХЃЉЃЎ
AЃЎгУЮТЖШМЦВтЖЈNaOHШмвКЦ№ЪМЮТЖШКѓжБНгВтЖЈбЮЫсЕФЮТЖШ
BЃЎСПШЁбЮЫсЕФЬхЛ§ЪБбіЪгЖСЪ§
CЃЎЗжЖрДЮАбNaOHШмвКЕЙШыЪЂгабЮЫсЕФаЁЩеБжа
DЃЎЪЕбщзАжУБЃЮТЁЂИєШШаЇЙћВю
ЂђЃЎЫсМюжаКЭЕЮЖЈЃЎ
гћВтЖЈФГNaOHШмвКЕФЮяжЪЕФСПХЈЖШЃЌПЩгУ0.1000 molЁЄL-1 HClБъзМШмвКНјаажаКЭЕЮЖЈ(гУЗгЬЊзїжИЪОМС)ЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉМюЪНЕЮЖЈЙмгУеєСѓЫЎЯДОЛКѓЃЌНгЯТРДгІИУНјааЕФВйзїЪЧ__________________________ЁЃ
ЃЈ2ЃЉШєМзбЇЩњдкЪЕбщЙ§ГЬжаЃЌМЧТМЕЮЖЈЧАЕЮЖЈЙмФквКУцЖСЪ§ЮЊ1.10 mLЃЌЕЮЖЈКѓвКУцШчЭМЃЌдђДЫЪБЯћКФБъзМШмвКЕФЬхЛ§ЮЊ___________ЁЃ

ввбЇЩњзіСЫШ§зщЦНааЪЕбщЃЌЪ§ОнМЧТМШчЯТЃК
ЪЕбщађКХ | Д§ВтNaOHШмвКЕФЬхЛ§/mL | 0.1000molЁЄL-1HClШмвКЕФЬхЛ§/mL | |
ЕЮЖЈЧАПЬЖШ | ЕЮЖЈКѓПЬЖШ | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
ЃЈ3ЃЉбЁШЁЩЯЪіКЯРэЪ§ОнЃЌМЦЫуГіД§ВтNaOHШмвКЕФЮяжЪЕФСПХЈЖШЮЊ________________(аЁЪ§ЕуКѓБЃСєЫФЮЛ)ЁЃ
ЃЈ4ЃЉЯТСаФФаЉВйзїЛсЪЙВтЖЈНсЙћЦЋИп___________(ЬюађКХ)ЁЃ
AЃЎзЖаЮЦПгУеєСѓЫЎЯДОЛКѓЃЌжБНгзЂШыД§ВтШмвКНјааЕЮЖЈ
BЃЎЕЮЖЈЕНжеЕуЖСЪ§ЪБЃЌЗЂЯжЕЮЖЈЙмМтзьДІаќЙввЛЕЮШмвК
CЃЎМюЪНЕЮЖЈЙмгУеєСѓЫЎЯДЕгКѓСЂМДШЁгУ25.00mLД§ВтвКзЂШызЖаЮЦПжаНјааЕЮЖЈ
DЃЎЕЮЖЈЧАИЉЪгЕЮЖЈЙмЖСЪ§ЃЌЕЮЖЈКѓЦНЪгЕЮЖЈЙмЖСЪ§
ЃЈ5ЃЉЕЮЖЈДяЕНжеЕуЕФБъжОЪЧ_________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com