
【题目】下列关于元素周期表的说法正确的是( )
A. 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
B. 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C. 除短周期外,其它周期均为18种元素
D. 周期表中所有元素都是从自然界中发现的
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为molL﹣1 .
(2)现用该浓盐酸配制100mL 1molL﹣1的稀盐酸.可供选用的仪器有:
①胶头滴管 ②烧瓶 ③烧杯 ④药匙
⑤量筒 ⑥托盘天平
配制稀盐酸时,上述仪器中需要使用的有(选填序号),还缺少的仪器有(写仪器名称).
(3)配制100mL 1molL﹣1的稀盐酸需要用量筒量取上述浓盐酸的体积为mL(保留一位小数),量取浓盐酸时应选用(选填①10mL ②50mL ③100mL)规格的量筒.
(4)实验中造成所配溶液浓度偏高的原因可能是 .
A.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
B.用量筒量取液体时仰视读数
C.烧杯没有洗涤
D.某同学在定容观察液面时俯视
E.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
F.容量瓶中原来含有少量蒸馏水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转. 
请回答下列问题:
(1)甲池为(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为 .
(2)丙池中F电极为(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的化学方程式为 .
(3)当乙池中C极质量减轻4.32g时,甲池中B电极理论上消耗O2的体积为mL(标准状况).
(4)一段时间后,断开电键K.下列物质能使乙池恢复到反应前浓度的是(填字母).
A.Cu
B.CuO
C.Cu(OH)2
D.Cu2(OH)2CO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(I)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH3+ ) B.碳负离子(CH3﹣) C.甲基 (﹣CH3) D.碳烯(:CH2)
①四种微粒中,键角为120°的是(填序号).
②碳负离子(CH3﹣)的空间构型为 , 与CH3﹣互为等电子体的一种分子是(填化学式).
(II )在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①C、N、O的电负性由大到小的顺序为 .
②写出Cu的核外电子排布式 .
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为 .
④在一定条件下NH3和CO2能合成尿素CO(NH2)2 , 尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为 .
⑤Cu2O晶体的晶胞结构如图所示,若阿伏伽德罗常数为NA , 晶胞的边长为apm,则晶体的密度为gcm﹣3 . 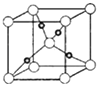
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
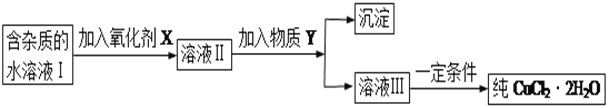
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于炔烃的描述正确的是( )
A.分子里含有碳碳三键的不饱和链烃叫炔烃
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于煤、石油、天然气等资源的说法正确的是( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化工原料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害,某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源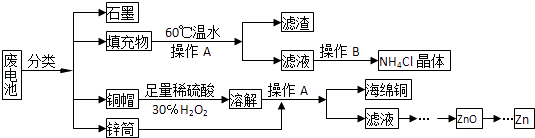
(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示).铜帽溶解完全后,可采用方法除去溶液中过量的H2O2 .
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.①当1molMnO2参加反应时,整个反应共有mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系.
(1)若A是一种红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是 , B在反应中表现出的性质是、 .
(2)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式;实验室检验C的方法 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com