
【题目】已知 2Fe2+ +Br2 = 2Fe3+ + 2Br-;2 Br- + Cl2 = Br2 + 2Cl-;2Fe3+ + 2I-= 2Fe2+ + I2。向 FeI2、FeBr2 的 混合溶液中通入 Cl2,溶液中某些离子的物质的量 n(离子)随通入 Cl2 的物质的量 n(Cl2)变化如图所示。则下列有关说法中不正确的是( )
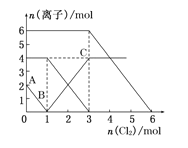
A. 还原性:I>Fe2+>Br
B. 原溶液中:n(Fe2+):n(I):n(Br)=2:1:3
C. 原混合溶液中 FeBr2 的物质的量为 6 mol
D. 当通入 2mol Cl2 时,溶液中已发生的离子反应可表示为:2Fe2++2I+2Cl2═2Fe3++I2+4Cl
【答案】C
【解析】
根据微粒的还原性大小比较、反应的先后顺序、溶液中微粒浓度的大小及图像内容等信息分析解答。
A.2Fe2+ +Br2 = 2Fe3+ + 2Br-中还原性Fe2+>Br=, 2 Br-+ Cl2 = Br2 + 2Cl-中的还原性Br->Cl-,2Fe3+ + 2I-= 2Fe2+ + I2中的还原性I->Fe2+,所以还原性大小顺序为:I>Fe2+>Br,故A正确;
B. 根据方程式中微粒间的关系可知:A—B点,氯气消耗1mol,即n(I-)=2mol,所以原混合溶液中FeI2的物质的量为1 mol;在BC段发生反应:2Fe2++Cl2===2Fe3++2Cl-;n(Cl2) = 2mol,所以n(Fe2+)=4mol,在C后发生反应:Cl2+2Br-===2Cl-+Br2 ,n(Cl2) = 3mol,所以n(Br-)=6mol,故n(Fe2+):n(I):n(Br)=4:2:6=2:1:3,故B正确;
C.由于溶液中的n(Br-)=6mol,所以原混合溶液中FeBr2的物质的量为3 mol,故C错误;
D.当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】对NaCl溶液进行蒸发结晶操作时,下列操作的正确顺序是( )
①放置酒精灯②固定铁圈位置③放置蒸发皿④加热搅拌⑤停止加热,余热蒸干
A.②③④⑤①
B.①②③④⑤
C.①③②④⑤
D.②①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述做法能改善空气质量的是( )
A.以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能等能源替代化石能源
C.鼓励私人购买和使用汽车代替公交车
D.限制使用电动车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了将粗 MnO2(含有较多的 MnO 和 MnCO3)样品转化为纯 MnO2 实验, 其流程如下:

(1)第①步加稀 H2SO4 时,粗 MnO2 样品中的______(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式: + ClO3+ = MnO2↓+ Cl2↑+ 请配平___________________________________________________
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、_____、_____,已知蒸发得到的固体中有 NaClO3 和 NaOH,则一定还有含有_____(写物质名称)。
(4)若粗 MnO2 样品的质量为 12.69g,第①步反应后,经过滤得到 8.7gMnO2,并收集到 0.224 L CO2(标 准状况下),则在第②步反应中至少需要______molNaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应方向的说法正确的是
A. 凡是放热反应都是自发反应 B. 凡是熵增大的反应都是自发反应
C. 凡是吸热反应都不是自发反应 D. 反应是否自发,不只与反应热有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨以及含氮废水的处理一直是工业研究的热点。回答下列问题:
(1)已知:氢气的燃烧热为-285.8kJ/mol,17g氨气在纯氧中燃烧生成氮气和液态水的过程中放热382.6kJ,则工业合成氨的热化学方程式为_________________。
(2)500℃时,在容积固定的密闭容器中模拟工业合成氢N2+3H2![]() 2NH3,下表为容器中部分物质浓度随时间的变化情况(其余浓度未给出)。
2NH3,下表为容器中部分物质浓度随时间的变化情况(其余浓度未给出)。
时间/min | c(N2)/mol/L | c(H2)/mol/L | c(NH3)/mol/L |
0 | 0.18 | 2.3 | 0 |
5 | 0.08 | ||
6 | 0.08 | ||
10 | 0.06 | 1.94 | 0.24 |
500℃时,该反应的化学平衡常数K=_______L2·mol-2;5min内,反应的平均速率v(H2)_____ mol·L-1·min-1;6min时,某一条件发生了改变,可能是_____(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.分离出NH3
(3)无机含氮废水主要含有铵氮(NH4+)和硝氮(NO3-)。可使用电化学氧化法处理铵氮废水,原理是溶液中的NH4+直接在电极上放电生成无毒物质,该过程阳极上的电极反应式为_______________。为研究电化学氧化法去除铵氮的影响因素,在实验室中以石墨作电极模拟对高浓度铵氮废水进行电化学氧化处理,得到如下3组图像:



通过分析上述图像可知,最适宜选用的条件是___________、以及初始pH为11的碱性溶液。实验中,铵氮去除率总是高于总氮去除率的原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com