
| A. | 有能量变化的过程一定是化学变化过程 | |
| B. | 需要加热才能发生的反应是吸热反应 | |
| C. | 化学反应中一定伴有热量的变化 | |
| D. | 物质发生燃烧的反应一定是放热反应 |
分析 A、化学变化一定伴随着能量的变化,物理变化也可以伴随着能量的变化;
B、吸放热反应与反应条件无必然的联系;
C、化学变化一定伴随着能量的变化;
D、燃烧是发光放热的剧烈的氧化还原反应.
解答 解:A、化学变化一定伴随着能量的变化,物理变化也可以伴随着能量的变化,故有能量变化的过程不一定是化学变化,故A错误;
B、吸放热反应与反应条件无必然的联系,故需要加热的不一定是吸热反应,故B错误;
C、化学变化一定伴随着能量的变化,但不一定是热量的变化,故C错误;
D、燃烧是发光放热的剧烈的氧化还原反应,故燃烧一定是放热反应,故D正确.
故选D.
点评 本题考查了吸放热反应与反应条件,应注意的是吸热反应不一定需要加热,需要加热的反应也不一定是吸热反应.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题

 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙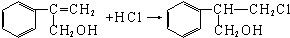 (不需注明反应条件).
(不需注明反应条件).
 .
. 、
、 、
、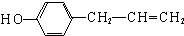 (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | Na2S溶液中滴加NClO溶液:S2-+ClO-+H2O═S↓+Cl-+2OH- | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属被腐蚀的本质是M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 对某些工具的“机械转动部位”选用刷油漆的方法来防锈 | |
| C. | 金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀 | |
| D. | 常温下,置于空气中的金属主要发生化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
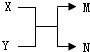
| A. | 若X为Fe,N为氢气,则Y一定为酸 | |
| B. | 若X、N为化合物,Y为水,则M一定是气体单质 | |
| C. | 若X、Y、M、N均为化合物,该反应一定属于复分解反应 | |
| D. | 若X、Y、M、N均为10电子微粒,且M是工业生产HNO3的一种原料气,则N常温下一定呈液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
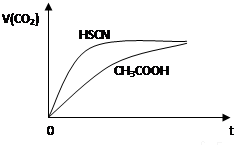
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com