
在一定条件下发生反应:2A(g)+2B(g)⇌xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L•min),下列说法正确的是( )
|
| A. | A和B的转化率均是20% |
|
| B. | x=4 |
|
| C. | 平衡时A的物质的量为2.8mol |
|
| D. | 平衡时气体压强比原来减小 |
| 化学平衡的计算. | |
| 专题: | 计算题;化学平衡专题. |
| 分析: | 根据反应速率之比等于化学计量数之比来确定化学计量数x,VD=0.2mol/(L•min),VC= 2A(g)+2B(g)⇌4C(g)+2D(g), 开始 4 2 0 0 转化0.8 0.8 1.6 0.8 平衡3.2 1.2 1.6 0.8 结合转化率的概念及物质的量之比等于压强之比来计算. |
| 解答: | 解:VD=0.2mol/(L•min),VC= 2A(g)+2B(g)⇌4C(g)+2D(g), 开始 4 2 0 0 转化0.8 0.8 1.6 0.8 平衡3.2 1.2 1.6 0.8 A.A的转化率为 B.由上述分析可知,x=4,故B正确; C.平衡时A的物质的量为3.2mol,故C错误; D.平衡时气体的物质的量之和为3.2mol+1.2mol+1.6mol+0.8mol>4mol+2mol,则反应后压强增大,故D错误; 故选B. |
| 点评: | 本题考查化学平衡的计算,熟悉化学平衡的三段法计算及转化率的计算即可解答,注意反应速率与化学计量数的关系、化学计量数与压强的关系来解答,题目难度中等. |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固体X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
查看答案和解析>>
科目:高中化学 来源: 题型:
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.已知:
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g•cm﹣3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程:
紫菜→(焙烧)→(浸取) (操作①)
(操作①) (操作②)→(蒸馏)→粗产品
(操作②)→(蒸馏)→粗产品
(1)实验室中焙烧紫菜用到的仪器有 .
A.烧杯 B.蒸发皿 C.坩埚 D.试管 E.酒精灯 F.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式 .
(3)操作①的名称是 ;试剂A为 (填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:
Ⅰ ;
Ⅱ .
(4)操作②应在 (仪器名称)中振荡、静置,操作时先分离出的是 .
(5)将下列装置图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离: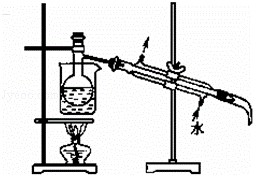
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 |
|
| B. | NH4HCO3(s) |
|
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可单独作为反应自发性的判据 |
|
| D. | 在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如表.据此判断下列结论正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L﹣1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L﹣1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L﹣1) | 1 | 2.5 | 3 | 3 |
|
| A. | 在t3时刻反应已经停止 |
|
| B. | A的转化率比B的转化率低 |
|
| C. | 该温度下此可逆反应平衡常数K=4 |
|
| D. | 该反应的化学方程式为2A(g)+B(g)⇌C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)⇌2SO3(g)△H<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
|
| A. | 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
|
| B. | 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
|
| C. | 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
|
| D. | 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ•mol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为 .
(2)利用反应6NO2+8NH3 7N2+12H2O处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 L.NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为: .
7N2+12H2O处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 L.NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为: .
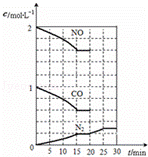
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g);△H<0.该反应的化学平衡常数表达式为K= 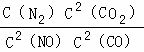 ,该反应△S 0(填“>”或“<”)若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填序号).
,该反应△S 0(填“>”或“<”)若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42﹣而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中只存在OH-、H+、NH 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH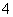 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(Cl-)>c(NH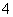 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH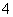 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH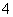 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为__________;
若上述关系中④是正确的,则溶液中的溶质为____________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”或“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系c(H+)________c(OH-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com