
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
分析 A.发生沉淀的转化;
B.至刚好沉淀完全,以1:1反应,生成硫酸钡、水、一水合氨;
C.反应生成氢氧化铝和氯化铵;
D.发生氧化还原反应生成硫酸钙.
解答 解:A.向AgCl沉淀中滴入饱和KI溶液反应,发生沉淀的转化,离子方程式为AgCl+I-=AgI+Cl-,故A正确;
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全的离子反应为Ba2++2OH-+NH4++H++SO42-=BaSO4↓+H2O+NH3•H2O,故B错误;
C.向A1C13溶液中加入过量的氨水的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.向Ca(ClO)2溶液中通入适量SO2的离子反应为Ca2++ClO-+SO2+H2O=CaSO4↓+2H++Cl-,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重沉淀转化、复分解反应、氧化还原反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
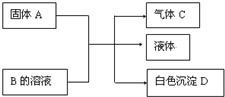 (1)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如图所示.
(1)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如图所示.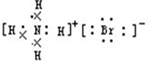 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| M | Y | Z |
| A. | 原子半径大小为Z>Y>M>X | |
| B. | 最高价氧化物的水化物的酸性强弱为X>Z>Y>M | |
| C. | 均形成简单离子,简单离子半径大小为M>Y>Z>X | |
| D. | X、M或Y、M不可能同为金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 测0.01mol/L的醋酸的pH为5:CH3COOH?CH3COO-+H+ | |
| B. | 电解饱和食盐水,产生气体:2Cl-+2H2O$\frac{\underline{\;高温\;}}{\;}$Cl2↑+2OH-+H2↑ | |
| C. | 铁放在氧气中燃烧,产生黑色固体:4Fe+3O 2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | |
| D. | 硫酸钙与碳酸钠溶液,产生白色沉淀:CaSO4(S)+CO32-?CaCO3(S)+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SnH4>GeH4>SiH4>CH4 | B. | SbH3>AsH3>PH3>NH3 | ||
| C. | HI>HBr>HCl>HF | D. | H2Te>H2Se>H2S>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )
实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )| 选项 | 试剂a | 试剂b | 试剂c | c中的现象 |
| A | 浓氨水 | 生石灰 | 硝酸银溶液 | 先沉淀后消失 |
| B | 稀硝酸 | 银 | 水 | 试管口无明显现象 |
| C | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 溶液颜色没有变化 |
| D | 稀硫酸 | 纯碱 | 硅酸钠溶液 | 先沉淀后消失 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com