
| A. | ③ | B. | ④⑤ | C. | ①②③ | D. | ③④ |
分析 根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断.
解答 解:①锥形瓶用蒸馏水洗净后再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,会造成c(待测)偏高,故①错误;
②滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,会造成c(待测)偏高,故②错误;
③滴定前仰视滴定管读数,滴定后平视刻度读数,NaOH溶液体积偏小,c(待测)偏小,故③正确;
④摇动锥形瓶时有少量液体溅出瓶外,消耗的标准液体积偏小,测定结果偏小,故④正确;
⑤锥形瓶里加入少量蒸馏水稀释溶液,不影响待测液的物质的量,滴定过程中不影响消耗的标准液的体积,不影响测定结果,故⑤错误;
故选D.
点评 本题考查了酸碱中和滴定的误差分析,该题是中等难度的试题,试题基础性强,难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,注意明确误差分析的方法.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 在50mL量筒中配制0.1000mol•L-1碳酸钠溶液 | |
| B. | 仅用烧杯、量筒、玻璃棒就可以配制100mL0.1000mol•L-1K2Cr2O7溶液 | |
| C. | 用100mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100mLpH=2的盐酸 | |
| D. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

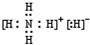 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合价的升降,化合价的升高和降低的总数相等 | |
| B. | 电子的转移,得电子总数和失电子总数相等 | |
| C. | 得氧和失氧,氧原子数目不变 | |
| D. | 物质的种类发生改变,质量守恒定律 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | B的最高价氧化物水化物的碱性强于A的最高价氧化物水化物的碱性 | |
| C. | 1molA与酸反应生成的H2比1molB与酸反应生成的H2多 | |
| D. | 常温时,A能从水中置换出氢气,而B不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27.5 mL | B. | 17.5 mL | C. | 15 mL | D. | 3 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| B. | 任何条件下,等物质的量的乙烯(C2H4)和一氧化碳所含的分子数必然相等 | |
| C. | 1 L一氧化碳气体一定比1 L氧气的质量小 | |
| D. | 同温同压下,等体积的物质所含的分子数一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com