


已知:
| 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是_______________。
②试管C置于冰水浴中的目的是____________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。中和饱和食盐水,振荡、静置、分层,环己烯在层____________ (填“上”或“下”),分液后用____________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO
②再将环己烯按下图装置蒸馏,冷却水从____________口进入。蒸馏时要加入生石灰,目的是____________________________________。
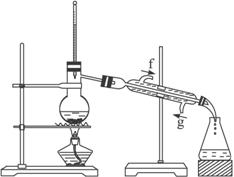
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是( )
a.用酸性KMnO4 b.用金属钠 c.测定沸点
科目:高中化学 来源: 题型:阅读理解

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | 环己醇 | 0.96 | 25 | 161 | 能溶于水 | 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
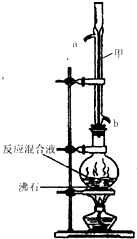 (2012?闸北区二模)苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
(2012?闸北区二模)苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g?cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 16m3 |
| m-m3 |
| 16m3 |
| m-m3 |
查看答案和解析>>
科目:高中化学 来源:2006年普通高等学校招生全国统一考试(上海)、化学 题型:058
| |||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com