
 (1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)分析 (1)单位相同条件下,不同物质的化学反应速率与其计量数的比值越大该反应速率越大;
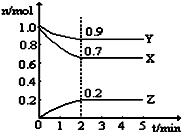
(2)①根据图知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物、Z是生成物,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比,据此反应书写方程式;
②v(Z)=$\frac{\frac{△n(Z)}{V}}{△t}$;
③该反应方程式为3X+Y?2Z,反应前后气体总质量不变,但物质的量减小,根据M=$\frac{m}{n}$、ρ=$\frac{m}{V}$判断相对分子质量、密度是否改变;
④在第2min时,X的转化率=$\frac{参加反应的n(A)}{初始n(A)}$×100%;
⑤反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),根据方程式知,参加反应的n(X)=1.5n(Z),参加反应的n(Y)=0.5n(Z),所以反应初始a=n(Z)+1.5n(Z)=2.5n(Z),b=n(Y)+0.5n(Z).
解答 解:(1)单位相同条件下,不同物质的化学反应速率与其计量数的比值越大该反应速率越大,①$\frac{v(A)}{3}$=$\frac{1mol/(L.min)}{3}$=$\frac{1}{3}$mol/(L•min)②$\frac{v(C)}{2}$=$\frac{0.5}{2}$ mol/(L•min)=0.25 mol/(L•min)、③$\frac{v(B)}{1}$=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②,
故答案为:③>①>②;
(2)①根据图知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物、Z是生成物,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比,△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,所以该反应方程式为,
故答案为:3X+Y?2Z;
②v(Z)=$\frac{\frac{△n(Z)}{V}}{△t}$=$\frac{\frac{0.2mol}{5L}}{2min}$=0.02mol/(L.min),
故答案为:0.02 mol•L-1•min-1;
③该反应方程式为3X+Y?2Z,反应前后气体总质量不变,但物质的量减小,容器体积不变,根据M=$\frac{m}{n}$知,反应前后混合气体相对分子质量增大、根据ρ=$\frac{m}{V}$知,反应前后混合气体密度不变,
故答案为:大;相等;
④在第2min时,X的转化率=$\frac{参加反应的n(A)}{初始n(A)}$×100%=$\frac{0.3mol}{1.0mol}$×100%=30%,
故答案为:30%;
⑤反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),根据方程式知,参加反应的n(X)=1.5n(Z),参加反应的n(Y)=0.5n(Z),所以反应初始a=n(Z)+1.5n(Z)=2.5n(Z),b=n(Y)+0.5n(Z)=1.5n(Z),所以a:b=2.5n(Z):1.5n(Z)=5:3,
故答案为:5:3.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,把握各个物理量之间的关系式是解本题关键,注意:化学反应速率大小比较时单位要统一,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾净水:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2C1- | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
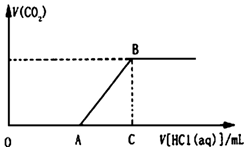 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中氧化剂和还原剂一定是两种物质 | |
| B. | 氧化还原反应中氧化产物和还原产物一定是两种物质 | |
| C. | 作氧化剂的物质一定不能作还原剂 | |
| D. | 所含元素处于中间价态时的物质,既可作氧化剂也可作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
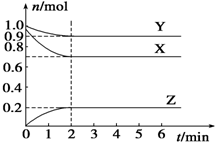 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应,吸热反应的生成物总能量一定高于反应物总能量 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| D. | 一定条件下4 HCl(g)+O2(g)═2Cl2(g)+2H2O(g),当1 mol O2反应放出115.6 kJ热量,键能如下所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ Cl2(g)$\stackrel{243kJ/mol}{→}$2Cl(g) O2(g)$\stackrel{498kJ/mol}{→}$2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 CH3COOCH2CH3+H2O;反应类型酯化反应.
CH3COOCH2CH3+H2O;反应类型酯化反应.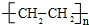 ;反应类型加聚反应.
;反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 三种酸的酸性为HX<HY<HZ | |
| B. | 物质的量浓度相同的三种盐的水溶液中,NaZ的溶液中,水的电离程度最大 | |
| C. | pH值相同的三种酸的水溶液,恰好中和时所耗NaOH的物质的量为HX<HY<HZ | |
| D. | 物质的量浓度相同的HZ和NaX能发生HZ+NaX=HX+NaZ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com