Ⅰ.(1)根据盐类水解的规律,无弱不水解,有弱才水解,越弱越水解,谁强显谁性,Na
2CO
3为强碱弱酸盐,水解呈碱性,所以用碱式滴定管,
故答案为:碱式滴定管;
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、搅拌器以及量筒,
故答案为:环形玻璃搅拌棒、量筒;
(3)实验中为准确测定结晶水的值,应分别测定坩埚的质量、坩埚与晶体的总质量,以此测定晶体的质量,然后称量加热后坩埚与固体总质量,之后再加热,至少再称一次以判断晶体是否完全分解,所以至少称量4次,
故答案为:4;
Ⅱ.(1)配制氢氧化铜悬浊液时NaOH一定要过量,否则氢氧化铜受热会分解生成黑色的氧化铜,所以这样的操作确保氢氧化钠过量,氢氧化铜呈悬浊状,
故答案为:确保氢氧化钠过量,氢氧化铜呈悬浊状;
(2)Ⅰ、紧紧围绕“红色”来猜想,因为铜也是红色的,所以红色沉淀可能是Cu、Cu
2O或者二者混合物;
【设计方案】:方案1:由于Cu、Cu
2O都能与稀硝酸反应,得到蓝色溶液,所以方案1不行;
方案2:Cu
2O与稀硫酸反应有Cu生成,有残渣,Cu不与稀硫酸反应有残渣,所以方案2不行;
方案3:铜在空气中灼烧生成CuO,Cu
2O在空气中灼烧也生成氧化铜,但两者增加的质量不同.
agCu在空气中灼烧,完全反应后质量变为
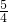
ag,agCu
2O在空气中灼烧,完全反应后质量变为
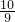
ag,所以ag红色沉淀在空气中灼烧完全反应后,当b为
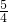
ag时红色沉淀Cu;当b为
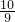
ag,时红色沉淀 Cu
2O;当
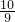
a g<b<
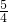
a g,时红色沉淀为两者混合物,所以方案3合理,
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,铜和稀硝酸反应,铜无法与银离子反应,所以方案4不行;
故答案为:红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜);方案3;
(3)解答此题时,应知道测定的原理;用此装置测定物质组成通常在如下两种途径:
氢气与Cu
2O反应的化学方程式为:Cu
2O+H
2 
2Cu+H
2O,结合装置图和化学方程式,硬质玻璃管+其中固体在反应前后质量差是Cu
2O中O的质量,通过氧的质量可求出Cu
2O的质量,再进一步判断是否含有Cu;此法需要测定的数据:②③⑤;
一般不用测氢气的体积、锌粒、稀硫酸中溶质的方法,因为在用氢气还原金属氧化物时,通常需要先通一段时间氢气,反应后还要再通一段时间氢气,再加上氢气并不都能与金属氧化物反应,部分氢气会白白浪费掉,所以实际参加反应氢气的量很难测定,
故答案为:②③⑤;
(4)铜在空气中灼烧生成CuO,加入足量稀硫酸溶解,CuO+H
2SO
4=CuSO
4+H
2O,提取硫酸铜晶体的方法用蒸发结晶的方法,用滤纸吸干或通入惰气带走水分,
故答案为:在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分;
分析:Ⅰ.(1)根据盐类的水解规律解答;
(2)根据量热计的构造和实验步骤来确定实验的仪器;
(3)实验中为准确测定结晶水的值,应分别测定坩埚的质量、坩埚与晶体的总质量,以此测定晶体的质量,然后称量加热后坩埚与固体总质量,之后再加热,至少再称一次以判断晶体是否完全分解,所以至少称量4次;
Ⅱ.(1)根据新制氢氧化铜验证醛类物质的还原性的实验原理和对氢氧化铜悬浊液的配制要求解答;
(2)Ⅰ、紧紧围绕“红色”来猜想,因为铜也是红色的,所以红色沉淀可能是Cu、Cu
2O或者二者混合物.
【设计方案】:方案1:由于Cu、Cu
2O都能与稀硝酸反应,进行分析;
方案2:Cu
2O与稀硫酸反应有Cu生成,有残渣,Cu不与稀硫酸反应有残渣,进行解答;
方案3:铜在空气中灼烧生成CuO,Cu
2O在空气中灼烧也生成氧化铜,但两者增加的质量不同;用极值法进行分析解答;
确定红色沉淀物;
方案4:酸化的硝酸银溶液相当于稀硝酸,铜无法与银离子反应;解答此题时,应知道测定的原理;用此装置测定物质组成通常在如下两种途径:
氢气与Cu
2O反应的化学方程式为:Cu
2O+H
2 
2Cu+H
2O,结合装置图和化学方程式,硬质玻璃管+其中固体在反应前后质量差是Cu
2O中O的质量,通过氧的质量可求出Cu
2O的质量,再进一步判断是否含有Cu;一般不用测氢气的体积、锌粒、稀硫酸中溶质的方法,因为在用氢气还原金属氧化物时,通常需要先通一段时间氢气,反应后还要再通一段时间氢气,再加上氢气并不都能与金属氧化物反应,部分氢气会白白浪费掉,所以实际参加反应氢气的量很难测定;
(4)根据绿色化学的理念设计化学实验;
点评:本题主要考查了一些实验操作,掌握实验的原理及正确的操作是解题的关键,题目难度中等.


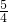 ag,agCu2O在空气中灼烧,完全反应后质量变为
ag,agCu2O在空气中灼烧,完全反应后质量变为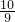 ag,所以ag红色沉淀在空气中灼烧完全反应后,当b为
ag,所以ag红色沉淀在空气中灼烧完全反应后,当b为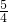 ag时红色沉淀Cu;当b为
ag时红色沉淀Cu;当b为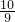 ag,时红色沉淀 Cu2O;当
ag,时红色沉淀 Cu2O;当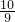 a g<b<
a g<b<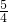 a g,时红色沉淀为两者混合物,所以方案3合理,
a g,时红色沉淀为两者混合物,所以方案3合理, 2Cu+H2O,结合装置图和化学方程式,硬质玻璃管+其中固体在反应前后质量差是Cu2O中O的质量,通过氧的质量可求出Cu2O的质量,再进一步判断是否含有Cu;此法需要测定的数据:②③⑤;
2Cu+H2O,结合装置图和化学方程式,硬质玻璃管+其中固体在反应前后质量差是Cu2O中O的质量,通过氧的质量可求出Cu2O的质量,再进一步判断是否含有Cu;此法需要测定的数据:②③⑤; 2Cu+H2O,结合装置图和化学方程式,硬质玻璃管+其中固体在反应前后质量差是Cu2O中O的质量,通过氧的质量可求出Cu2O的质量,再进一步判断是否含有Cu;一般不用测氢气的体积、锌粒、稀硫酸中溶质的方法,因为在用氢气还原金属氧化物时,通常需要先通一段时间氢气,反应后还要再通一段时间氢气,再加上氢气并不都能与金属氧化物反应,部分氢气会白白浪费掉,所以实际参加反应氢气的量很难测定;
2Cu+H2O,结合装置图和化学方程式,硬质玻璃管+其中固体在反应前后质量差是Cu2O中O的质量,通过氧的质量可求出Cu2O的质量,再进一步判断是否含有Cu;一般不用测氢气的体积、锌粒、稀硫酸中溶质的方法,因为在用氢气还原金属氧化物时,通常需要先通一段时间氢气,反应后还要再通一段时间氢气,再加上氢气并不都能与金属氧化物反应,部分氢气会白白浪费掉,所以实际参加反应氢气的量很难测定;


 +2H2O
+2H2O +2H2O
+2H2O NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+