
|
20℃时,a g KNO3溶于b g水中,恰好形成V mL饱和溶液.下列关系式错误的是 | |
A. |
该溶液的物质的量浓度c(KNO3)= |
B. |
该溶液的质量分数w(KNO3)= |
C. |
20℃时KNO3的溶解度S= |
D. |
该溶液的密度ρ= |
科目:高中化学 来源: 题型:
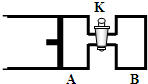 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同的温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0 达到平衡时,VA=1.2aL.则下列说法错误的是( )
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同的温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0 达到平衡时,VA=1.2aL.则下列说法错误的是( )查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南师大附中高二12月阶段检测化学试卷 题型:填空题
(14分) “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体在正极反应,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(3)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省舒城晓天中学高二下学期质量测试1化学试卷(带解析) 题型:填空题
(16分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)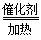 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=__________。
(2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。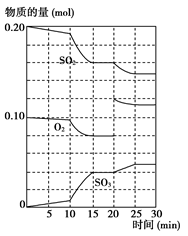
(4)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ __________________________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源:2012-2013学年内蒙古巴彦淖尔市一中高二9月月考化学试卷(带解析) 题型:填空题
(12分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1) 写出该反应的化学平衡常数表达式K=______ ____。降低温度,该反应K值___ ___,二氧化硫转化率______,化学反应速率___ ___。(以上均填“增大”“减小”或“不变”)
(2) 600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是____ ____。
(3)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ ___________________ (用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g)  2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态? (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”、“<”或“=”),原因是 。
2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态? (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”、“<”或“=”),原因是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习《化学反应速率与化学平衡》专题综合测试(苏教版) 题型:选择题
(2011·烟台诊断)某兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
|
|
A |
B |
C |
|
Ⅰ |
0.050 mol·L-1 |
0.050 mol·L-1 |
0.050 mol·L-1 |
|
Ⅱ |
0.070 mol·L-1 |
0.070 mol·L-1 |
0.098 mol·L-1 |
|
Ⅲ |
0.060 mol·L-1 |
0.060 mol·L-1 |
0.040 mol·L-1 |
|
Ⅳ |
0.080 mol·L-1 |
0.080 mol·L-1 |
0.12 mol·L-1 |
针对上述系列实验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com