
【题目】C2H4分子中 ( )
A. 有4个σ键,2个π键 B. 6个σ键
C. 3个π键 D. 5个σ键,1个π键
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值) ( )
A. 在常温、常压下,11.2 L N2含有的分子数是0.5NA
B. 标准状况下,22.4 L水所含水分子数约是NA
C. 32 g O2在标准状况下的体积约是22.4 L
D. 1 mol·L-1FeCl3溶液中所含Cl—的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃条件下,下列溶液中的粒子浓度关系正确的是( )
A.浓度相同的①CH3COONa溶液、②NaClO溶液、③NaCl溶液中的c(H+):②>①>③
B.NaHC2O4溶液中,c(H+)+c(Na+)=c(OH-)+c(C2O![]() )+c(HC2O
)+c(HC2O![]() )
)
C.NaOH溶液和NH4Cl溶液混合至溶液呈中性,则混合后的溶液中,c(Cl-)=c(NH![]() )+c(Na+)
)+c(Na+)
D.pH=6的NaHSO3溶液中:c(SO![]() )-c(H2SO3)=9.9×10-6 mol·L-1
)-c(H2SO3)=9.9×10-6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:X+2Y![]() 2Z(△H<0),其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是
2Z(△H<0),其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是
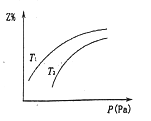
A. Y一定呈气态
B. T1大于T2
C. 升高温度,该反应的化学平衡常数增大
D. 当c(X):c(Y):c(Z)=1:2:2时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
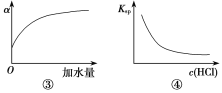
【题目】下列各表述与示意图一致的是( )
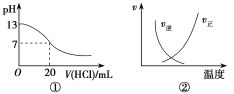
A.图①表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入盐酸体积的变化
B.图②中曲线表示反应N2(g)+O2(g)2NO(g) ΔH>0,正、逆反应速率随温度的变化
C.图③中曲线表示10 mL 0.01 mol·L-1醋酸的电离度α随加水量的变化
D.图④中曲线表示AgCl的溶度积Ksp随盐酸浓度c(HCl)的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于最外层只有两个电子的基态原子的说法,一定正确的是 ( )
A. 是ⅡA族元素
B. 是金属元素
C. 外围电子排布是ns2
D. 可能是主族元素,也可能是过渡元素,还可能是0族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=________。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_________________,由水电离出的c(OH-)=________ mol·L-1。
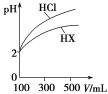
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX是________(填“强酸”或“弱酸”),理由是______________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为________(填化学式)。
②25 ℃时,在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com