
| A. | Cu(NO3)2和KOH | B. | Ca(ClO)2和Na2CO3 | C. | (NH4)2SO4和BaCl2 | D. | K2SO4和Na2CO3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸 | B. | 加入NaOH溶液 | C. | 加入澄清石灰水 | D. | 通入CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合小苏打和烧碱溶液 HCO3-+H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入氨水Al3++3OH-═Al(OH)3↓ | |
| C. | 加热碳酸氢钙溶液 Ca2++2HCO3-═CaCO3↓+H2O+CO2↑ | |
| D. | 氢氧化镁中加入稀硫酸H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
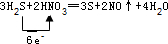 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CCl4所含原子数目为2.5NA | |
| B. | 常温常压下,64g SO2中含有的原子数为3NA | |
| C. | 将1 mol Cl2通入水中能生成1mol HClO | |
| D. | 2L 0.1 mol•L-1K2SO4溶液中含K+物质的量为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
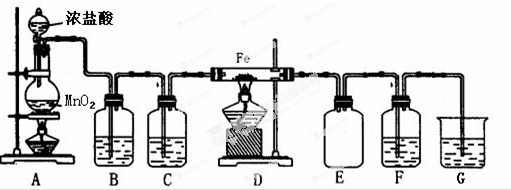
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现代化学元素分析测试中,可用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素,用红外光谱仪确定物质中是否存在某些有机原子团,用原子吸收光谱确定物质中含有哪些金属元素等 | |
| B. | 钠钾合金在常温下是液体,可用于快中子反应堆作剂;镁合金大量用于制造火箭、导弹和飞机的部件等 | |
| C. | 2015年浙江省多地遭遇雾霾天气,有报道称雾霾颗粒中汽车尾气占20%以上,一致汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质,其中PM2.5(OM单位为百万分之一米)颗粒大小约等于胶体粒子 | |
| D. | 如图所示为四大基本反应及其关系,则反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O属于区域3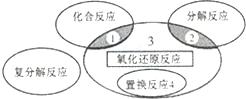 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com