
| A. | 胆固醇: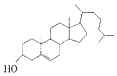 | B. | 芬必得: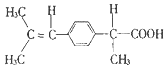 | ||
| C. | 保幼激素JH-I: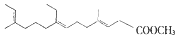 | D. | 维生素C: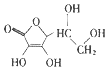 |
科目:高中化学 来源: 题型:解答题
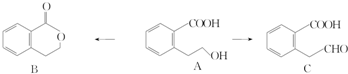
 (或
(或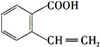 ),A分子中一定共面的碳原子有8个.
),A分子中一定共面的碳原子有8个.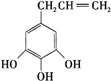 (或
(或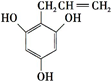 )(任写一种).
)(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
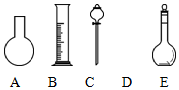 实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的系统命名:3-甲基-2-乙基戊烷 | |
| B. | 氨基乙酸和硝基乙烷互为同分异构体 | |
| C. | 乙烯和1,3-丁二烯属于同系物CH3 | |
| D. | 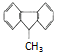 一氯代物有5种 一氯代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
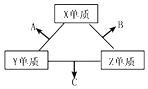 三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )
三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )| A. | 原子半径:Z<Y<X | B. | 非金属性 Z>Y>X | ||
| C. | 化合物A易溶于水 | D. | 化合物B与C的混合物呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com