
����Ŀ����.������أ�K2FeO4����һ�����͡���Ч�������ɫ����ˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
��1���ɷ��Ʊ�������ص���Ҫ��ӦΪ��2FeSO4�� 6Na2O2=2Na2FeO4��2Na2O��2Na2SO4��O2�����÷�Ӧ�й������ƣ�Na2O2������Ԫ�ػ��ϼ�Ϊ______������������________________���ѧʽ����
��2��ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ�����������ӣ�Fe(OH)3��ClO����OH����FeO42����Cl����H2O��
�ټ��������£��������ͻ�ԭ�������ʵ����ı�Ϊ3:2������Ӧ��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��_____________________________________________��
��ÿ����1 mol FeO42��ת��________mol���ӣ�����Ӧ������ת����0.3 mol���ӣ���ԭ��������ʵ���Ϊ________mol��
��.��֪��2Fe3++2I-=2Fe2++I2 ,2Fe2++Br2=2Fe3++2Br-��
(1)����1 mol FeI2��2 mol FeBr2����Һ��ͨ��2 mol Cl2����ʱ��������������________��
(2)����a mol FeI2��b mol FeBr2����Һ��ͨ��c mol Cl2����I-��Fe2+��Br-��ȫ������ʱ��cΪ__________________���ú�a��b�Ĵ���ʽ��ʾ����
���𰸡�-1 Na2FeO4��O2 2Fe(OH)3+3ClO��+4OH��=2FeO42��+3Cl��+5H2O 3 0.15 I-��Fe2+ ��3a+3b��/2
��������
���ݻ��ϼ۱仯�ж��������ͻ�ԭ��������ת�Ƶ����غ�����������ͻ�ԭ�������ʵ�����ϵ��
��.(1)���������д��ڵ��ǹ���������Ԫ�ػ��ϼ�Ϊ��1�����������ǻ��ϼ�����֮��õ��IJ�����Ը÷�Ӧ��������Ϊ��Na2FeO4��O2��
(2) ���������ͻ�ԭ�������ʵ����ı�Ϊ3:2�����������ϼ۽�����Ԫ�صĻ��ϼ۱仯Ϊ2�ۣ���Ԫ�ػ��ϼ۱仯Ϊ3�ۣ����ݵ���ת���غ��жϣ�2Fe(OH)3Ϊ��ԭ����3ClO��Ϊ�����������ӷ���ʽΪ��2Fe(OH)3+3ClO��+4OH��=2FeO42��+3Cl��+5H2O��
����Ԫ�ذ����ϼ���+3������Ϊ+6�ۣ�����ÿ����1 mol FeO42��ת��3mol���ӣ���Ԫ�ػ��ϼ���+1����Ϊ-1����Ӧ������ת����0.3 mol���ӣ���ԭ��������ʵ���Ϊ0.3mol/2=0.15mol���ʴ�Ϊ��3 ��0.15��
��. (1) ��������ԭ��Ӧ�л�ԭ���Ļ�ԭ��ǿ�ڻ�ԭ����ģ����Ի�ԭ��ǿ��˳����I����Fe2����Br���������������������ĵ���I����Ȼ����Fe2���������Br�������ݵ��ӵĵ�ʧ�غ��֪��2mol����������2molI����2molFe2�������Դ�ʱ��������������I-��Fe2+��
(2) ���ݵ��ӵĵ�ʧ�غ��֪��2c��2a����a��b����2b����c��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ĿǰӦ����㷺�Ľ������ϣ��˽������ʴ��ԭ�����������������Ҫ���壬�Ը�����Ʒ���п���ʴ���������ʵ��ӳ���ʹ��������
��1������ʴ����ǰ�������г��������������⡣�ֽ�һ����������������������У��������������Һ�з����Ļ��Ϸ�Ӧ�Ļ�ѧ����ʽΪ��________________________��
��2��������ͼװ�ã�����ģ�����ĵ绯ѧ������
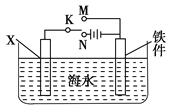
�ٿ���K�Ͽ�ʱ������Ϊ��������������Ҫ����_____��ʴ����XΪ̼����Ϊ���������ĸ�ʴ������KӦ����________����
����XΪп������K����M�����õ绯ѧ��������Ϊ________��
��3����ͼ����XΪ��ͭ����п�����ʣ��������к�ˮ�滻Ϊ����ͭ��Һ������K����N����һ��ʱ���������������127 gʱ��X�缫�ܽ��ͭ������________127 g(����<����>����������)�����������ͭ����Ч��ֹ������ʴ�������������δ����ͭ����Ʋ����𣬶�ͭ���ȶ�п���������ױ���ʴ�����Ҫ˵��ԭ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ����������ҵ�ϳ����ô���ԭ���ͼ����շ�����SO2���塣

(1)��ͼ��ʾ��1mol CH4��ȫȼ��������̬ˮ�������仯��1mol S(g)ȼ�յ������仯���ڴ��������£�CH4���Ի�ԭSO2���ɵ���S(g)��H2O(g)��CO2��д���÷�Ӧ���Ȼ�ѧ����ʽ________________________________________________________��
(2)��̿����ԭ��������Ļ�ѧ����ʽΪ2C(s)+2SO2(g)![]() S2(g)+2CO2(g)��һ��ѹǿ�£���1L�ܱ������г��������Ľ�̿��1molSO2������Ӧ�����SO2������������S2(g)�������������¶ȱ仯�Ĺ�ϵ��ͼ��ʾ��
S2(g)+2CO2(g)��һ��ѹǿ�£���1L�ܱ������г��������Ľ�̿��1molSO2������Ӧ�����SO2������������S2(g)�������������¶ȱ仯�Ĺ�ϵ��ͼ��ʾ��
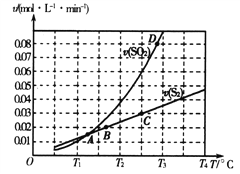
��A��B��C��D�ĵ��Ӧ��״̬�У��ﵽƽ��״̬����_____________(����ĸ)��
�ڸ÷�Ӧ�ġ�H_____0(�>����<����=��)��
�����д�ʩ�ܹ�����SO2ƽ��ת���ʵ���______________��
A�������¶� B������C���� C����С������� D�����Ӹ�Ч����
(3)�ð�ˮ����SO2��25��ʱ2��0mol��L-1�İ�ˮ�У�NH3��H2O�ĵ������=______(![]() ��100��)������SO2������ͨ��ð�ˮ�У�����Һ������ʱ����Һ�е�
��100��)������SO2������ͨ��ð�ˮ�У�����Һ������ʱ����Һ�е�![]() =_______��(��֪25�棬Kb(NH3��H2O)=1.8��10-5��Ka1(H2SO3)=1.3��10-2��Ka2(H2SO3)=6.2��10-8)
=_______��(��֪25�棬Kb(NH3��H2O)=1.8��10-5��Ka1(H2SO3)=1.3��10-2��Ka2(H2SO3)=6.2��10-8)
(4)������Һʧȥ����������ͨ��O2�ɵõ�NH4HSO4��Һ������ͼ��ʾװ�õ������NH4HSO4��Һ���Ƶ�ǿ������(NH4)2S2O8

��д�����NH4HSO4��Һ�Ļ�ѧ����ʽ____________��
������9��65A�ĺ㶨������ⱥ��NH4HSO4��Һ1Сʱ�����������ɵ�(NH4)2S2O8�����ʵ���Ϊ________��(F=96500C��mol-1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ��NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش�����������
��1��NH4Al(SO4)2������ˮ������ԭ����_____________(�ñ�Ҫ�Ļ�ѧ������������˵��)��
��2����ͬ��������0.1 mol��L-1 NH4Al(SO4)2��Һ�е�c(NH4+)________(����������������������С����)0.1 mol��L-1 NH4HSO4��Һ�е�c(NH4+)��
��3��Ũ�Ⱦ�Ϊ0.1 mol��L-1�ļ��ֵ������Һ��pH���¶ȱ仯��������ͼ��ʾ:

�����з���0.1 mol��L-1 NH4Al(SO4)2��Һ��pH���¶ȱ仯��������________������pH���¶ȱ仯��ԭ����________________________________________________��
��20 ��ʱ��0.1 mol��L-1 NH4Al(SO4)2��Һ��2c(SO42-)-c(NH4+)-3c(Al3+)=____________��
��4������ʱ����100 mL 0.1 mol��L-1 NH4HSO4��Һ�еμ�0.1 mol��L-1 NaOH��Һ����ҺpH��NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��
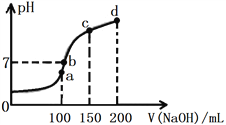
�Է���ͼ��a��b��c��d�ĸ�����ˮ�ĵ���̶�������________������b������Һ�и�����Ũ���ɴ�С������˳����______________________________________��
��5�����ܵ������ˮ��Һ�д����ܽ�ƽ����25����ijNH4Al(SO4)2��Һ��c(Al3+)=0.1molL��1��ʹAl3+��ʼ������pHΪ________����25��ʱ��Al(OH)3��Ksp=1��10-34��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
��������ͼ1��ʾװ�ý��е�һ��ʵ����
��1���ڱ�֤�缫��Ӧ���������£��������Cu���缫����_______������ĸ��ţ���
A. �� B. ʯī C. �� D. ��
��2��M��������Ӧ�ĵ缫��ӦʽΪ________��
��3��ʵ������У�SO42��________�����������������������������������������ƶ�����ֽ���ܹ۲쵽��������___________________��д������������ķ�Ӧ����ʽ��__________________��
��������ͼ2��ʾװ�ý��еڶ���ʵ����
��4��ʵ������У������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ�������������Ϸ��֣����������FeO42��������Һ�г��Ϻ�ɫ���������У�X������Һ��pH________������������������С����������������
��5���������У�Y�������ĵ缫��ӦΪFe��6e��+8OH���TFeO42��+4H2O �� 4OH����4e���T2H2O+O2��������X���ռ���672mL���壬��Y���ռ���168mL���壨��������Ϊ��״��ʱ�������������Y�缫�����缫����������________g��
��6���ڼ���п����У��ø��������Ϊ�������ϣ�����ܷ�ӦΪ��2K2FeO4+3Zn�TFe2O3+ZnO+2K2ZnO2 �õ�������ĵ缫��ӦʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����������ʢװ���Ũ������ij��ȤС���ͬѧ���֣���һ������������Ũ�������ʱ���۲쵽��������ȫ�ܽ⣬�������������塣Ϊ̽����Ӧ��IJ������Э�����������ص�ʵ�顣
[̽��һ]
��1������ȥ�����������������(̼�ظ�)�������Ũ�����У�10���Ӻ���������ͭ��Һ�У�Ƭ�̺�ȡ���۲죬�������������Ա仯����ԭ����________________________��
��2������ȡ����6.0g����15.0mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y��
����ͬѧ��ΪX�г�Fe3+����ܺ���Fe2+����Ҫ�ж���ҺX���Ƿ���Fe2+��Ӧѡ��________(�����)��
a��KSCN��Һ����ˮ b��K3[Fe(CN)6]��Һ c��Ũ��ˮ d������KMnO4��Һ
����ͬѧ��336mL(��״��)����Yͨ��������ˮ�У�������Һ��ɫ��Ǯ�����û�ѧ����ʽ������ˮ��ɫ��dz��ԭ��__________________________________________________________��Ȼ����Ӧ�����Һ�м�������BaCl2��Һ�����ʵ������ø������2.33g���ɴ���֪����Y��SO2���������Ϊ_________��
[̽����]
��������ʵ����SO2��������Ľ������ͬѧ��Ϊ����Y�л����ܺ���H2��Q���塣Ϊ�������ͼ��ʾ̽��ʵ��װ��(ͼ�мг�����ʡ��)��

��3��װ��A�з�����Ӧ�����ӷ���ʽΪ_____________________��װ��B���Լ���������____________��
��4����Ϊ����Y�л���������Q��������_____________________________(�û�ѧ����ʽ��ʾ)��
Ϊ�˽�һ��ȷ��Q�Ĵ��ڣ�����װ��������װ��M��_________(�����)��M�������Լ�Ϊ_________��
a��A��B֮�� b��B��C֮�� c��C��D֮�� d��E��F֮��
��5����������ʵ��װ�ý�һ��ȷ������Y���Ƿ���H2��Ϊ�ﵽԤ�ڵ�ʵ��Ŀ�ģ�����ǰ����װ��D��������Ϊmg����ͨ��336mL(��״��)����Y��ȫ��Ӧ����ͨ�뵪����װ��D��ȴ�����£�����װ��D������Ϊng����ԭ���������H2���������Ϊ__________��(�ú������ĸ�Ĵ���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ����
A. CH4ȼ�� B. ϡ�����NaOH��Һ��Ӧ
C. ����ʯ��ʯ D. Zn��ϡ���ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ơ�Ƶ���Ҫ�ɷ��к��оƾ���CH3CH2OH�������Ĺ������ǣ� ��
A.��COOHB.��OHC.��CH3D.��CH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ�����
(һ)���������������ʣ����� ������ ��CO2 ��H2SO4 ��Ba��OH��2 ���ɫ�������������� ��HCl ���ˮ����� ��̼��� ��CuSO4��5H2O��
(1)�������������ڵ���ʵ���__________������ţ���
(2)�����Һ���μӢߵ���Һ��������������________________________��
(3)����������������������ˮ��Һ�з�����Ӧ�������ӷ���ʽΪ��H++OH����H2O����÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
(��)(1)ij��̬�����ﻯѧʽΪRO2���ڱ�״���£�1.28 g��������������448 mL�����������Ħ������Ϊ_______��R�����ԭ������Ϊ__________��
(2)�ڱ�״���£�w L��������x��N2���ӣ����ӵ�����Ϊ____________����w��x��ʾ����
(3)���˺��ʳ��ˮ�Ժ��п����Ե�CaCl2��MgCl2��Na2SO4�����ʣ�ͨ�����¼���ʵ�鲽�裬���Ƶô�����ʳ��ˮ���ټ����Թ�����BaCl2��Һ���ڼ����Թ�����NaOH��Һ���ۼ����Թ�����Na2CO3��Һ���ܵ���ϡ�����������ݲ������ݹ��ˡ���ȷ�IJ���˳����________����д��ţ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com