
 2NaIO3+5NaHSO3═3NaHSO4+2Na2SO4+I2+H2O.
2NaIO3+5NaHSO3═3NaHSO4+2Na2SO4+I2+H2O.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、产生NO在标准状况下的体积为4.48L |
| B、Cu和Cu2O的物质的量之比为2:1 |
| C、Cu和Cu2O与硝酸反应后剩余HNO3的量为0.2mol |
| D、原硝酸的物质的量浓度为2.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向待测液中先加入盐酸酸化,再加入AgNO3溶液 | 白色沉淀 | 待测液中含有Cl- |
| B | 溶液X中滴入盐酸酸化的BaCl2溶液 | 白色沉淀 | 溶液X中一定含SO42- |
| C | 溶液Y中滴入NaOH溶液,加热,用湿润红色石蕊试纸检验 | 试纸变蓝 | 溶液Y中含NH4+ |
| D | 钠盐Z溶液中,加入稀盐酸,并将产生的气体通入石灰水 | 石灰水变浑浊 | Z一定是Na2CO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
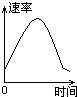
 对可逆反应:A(g)+2B(s)?C(s)+D(g);△H>0(正反应为吸热反应).如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是( )
对可逆反应:A(g)+2B(s)?C(s)+D(g);△H>0(正反应为吸热反应).如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是( )| A、②③ | B、①② | C、③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
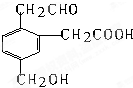 某有机物的结构式如图它在一定条件下可能发生的反应有①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥加聚( )
某有机物的结构式如图它在一定条件下可能发生的反应有①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥加聚( )| A、②③④ | B、①③⑤⑥ |
| C、①③④⑤ | D、②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mo1/L |
| B、0.2mol/L |
| C、0.1mol |
| D、0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
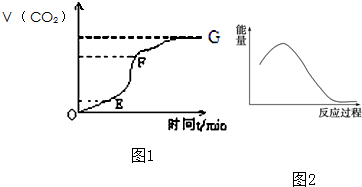
 (1)已知:H2(g)+O2(g)═H2O(g),反应过程中能量变化如图所示,则:
(1)已知:H2(g)+O2(g)═H2O(g),反应过程中能量变化如图所示,则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com