
下列叙述中正确的是( )
A.分子晶体中都存在共价键
B.F2、Cl2、Br2、I2的熔、沸点逐渐升高与分子间作用力有关
C.含有极性键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
气候变化和环境问题全球关注。以下做法有利于保护环境的是( )
A.野外焚烧垃圾
B.使用一次性木质筷子
C.大量使用化肥、农药
D.推广使用散装水泥
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
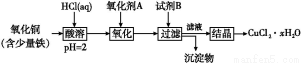
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用 (填编号,下同)。
①Cl2 ②H2O2 ③HNO3 ④KMnO4
(2)要得到较纯的产品,试剂B可选用 。
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)从滤液经过结晶得到氯化铜的方法是 (按实验先后顺序填编号)。
①过滤 ②冷却 ③蒸发浓缩 ④蒸发至干
(4)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体,加入足量10%的氢氧化钠溶液、过滤、洗涤后用小火加热至质量不再减轻为止,冷却、称量所得固体的质量为n g。
①方案一中灼烧CuCl2·xH2O得到无水CuCl2,应在 (填仪器名称)中进行。
方案二中配制一定量10%的氢氧化钠溶液,其操作步骤是计算、称量、 。
②试评价上述两种实验方案,其中可行的方案是 ,另一种方案不可行的理由是 ,若用方案二,计算得x= (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
某研究性学习小组为合成1 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线:
CH3CH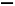 CH2+CO+H2
CH2+CO+H2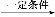 CH3CH2CH2CHO
CH3CH2CH2CHO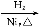 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;
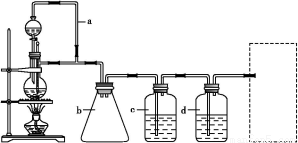
CO的制备原理:HCOOH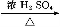 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2 丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。
丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , 。c和d中盛装的试剂分别是 , 。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)。
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水;④无水CuSO4;⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是 。
a.低温、高压、催化剂
b.适当的温度、高压、催化剂
c.常温、常压、催化剂
d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1 丁醇粗品。为纯化1
丁醇粗品。为纯化1 丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)
丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,1
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1 丁醇 118℃,并设计出如下提纯路线:
丁醇 118℃,并设计出如下提纯路线:
粗品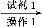 滤液
滤液
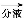 有机层
有机层 1
1 丁醇、乙醚
丁醇、乙醚 纯品
纯品
试剂1为 ,操作1为 ,操作2为 ,操作3为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
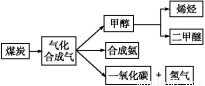
Ⅰ.已知该产业链中某反应的平衡常数表达式为:K=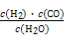 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:
。
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0 MPa,温度230~280 ℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
ΔH1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ΔH2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH3=-41.2 kJ·mol-1
(1)写出催化反应室中三个反应的总反应的热化学方程式: 。
(2)在某温度下,2 L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2 mol和6 mol,3 min后达到平衡,测得CO的转化率为60%,则3 min内CO的平均反应速率为 。若同样条件下起始时CO物质的量为4 mol,达到平衡后CH3OH为2.4 mol,则起始时H2为 mol。
(3)下列有关反应③的说法正确的是 。
A.在体积可变的密闭容器中,在反应③达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变
B.若830 ℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0
C.某温度下,若向已达平衡的反应③中加入等物质的量的CO和H2O(g),则平衡右移、平衡常数变大
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图,
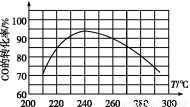
则CO转化率随温度变化的规律是 。
其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:选择题
在以下的分子或离子中,空间结构的几何形状不是三角锥形的是( )
A.NF3 B.CH3— C.BF3 D.H3O+
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:选择题
化学与环境保护密切相关,下列叙述正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.煤经气化和液化两个物理变化过程,可变为清洁燃料
C.PM2.5(2.5微米以下的颗粒物)的污染主要来自化石燃料的燃烧
D.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++OH-
H++OH- 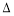 H>0,下列叙述正确的是( )
H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:填空题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC Si;SiCl4 SiO2。
(2)如图立方体中心的“”表示硅晶体中的一个原子,请在立方体的顶点用“”表示出与之紧邻的硅原子。

(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)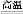 Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com