
分析 3A(g)+B(g)?xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,则
3A(g)+B(g)?xC(g)+2D(g),
开始(mol/L) 3 3 0 0
转化 3×60% 0.6 1.2
平衡 1.2 2.4 0.6x 1.2
(1)由上述分析可知平衡状态D的浓度;
(2)结合v=$\frac{△c}{△t}$计算;
(3)结合速率之比等于化学计量数之比计算;
(4)开始时容器中的压强与平衡时的压强之比等于反应前后的物质的量之和的比;
(5)依据化学方程式分析氨气化合价变化,判断发生氧化反应的物质是氨气,原电池中在负极失电子,正极上氧气得到电子生成氢氧根离子;结合化学方程式和电子转移总数计算每消耗3.4g NH3转移的电子数.
解答 解:3A(g)+B(g)?xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,则
3A(g)+B(g)?xC(g)+2D(g),
开始(mol/L) 3 3 0 0
转化(mol/L) 3×60% 0.6 1.2
平衡(mol/L) 1.2 2.4 0.6x 1.2
(1)由上述分析可知平衡状态D的浓度为1.2mol/L,故答案为:1.2;
(2)B的平均反应速率υ(B)=$\frac{0.6mol/L}{5min}$=0.12mol/( L.min),故答案为:0.12;
(3)由速率之比等于化学计量数之比可知,$\frac{1}{x}=\frac{0.12}{0.36}$,解得x=3,故答案为:3;
(4)开始时容器中的压强与平衡时的压强之比等于反应前后的物质的量之和的比,为(6+6)mol:(1.2+2.4+0.6×3+1.2)mol/L×2L=10:11,故答案为:10:11;
(5)电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH--6e-=N2+6H2O,反应中2mol氨气反应电子转移6mol电子,每消耗3.4g NH3物质的量=$\frac{3.4g}{17g/mol}$=0.2mol,转移的电子数为0.6NA;
故答案为:2NH3+6OH--6e-=N2+6H2O;0.6NA.
点评 本题考查化学平衡的计算以及电化学知识,为高频考点,把握化学平衡三段法计算、速率及压强比的计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 室温下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 加酚酞呈红色的溶液中:CO32-、Cl-、F-、NH4+ | |
| D. | c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用工业盐(NaNO2)作咸味调味品 | |
| B. | 用硫磺熏制银耳,使它颜色更白 | |
| C. | 食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐 | |
| D. | 将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
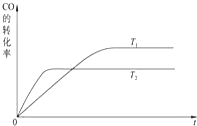 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com