
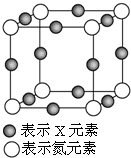
 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )
元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )| A. | X元素的原子序数为28 | |
| B. | 晶体中与一个N3-距离最近的Xn+为8个 | |
| C. | Xn+中n的值为1 | |
| D. | 该晶体中N3-与Xn+的个数比为3:1 |
分析 A.Xn+中所有电子正好充满K、L、M三个电子层,Xn+所含电子=2+8+18=28,故原子序数为28+n;
B.晶胞中Xn+处于棱中心,与之相邻的N3-离子处于Xn+所在棱的顶点;
C.根据均摊法计算晶胞中Xn+、N3-离子数目,再利用化合价代数和为0计算;
D.根据均摊法计算晶胞中Xn+、N3-离子数目.
解答 解:A.Xn+中所有电子正好充满K、L、M三个电子层,Xn+所含电子=2+8+18=28,故原子序数为28+1=29,故A错误,
B.晶胞中Xn+处于棱中心,与之相邻的N3-离子处于Xn+所在棱的顶点,晶体中每个Xn+周围有2个等距离且最近的N3-,故B错误;
C.晶胞中Xn+可知数目为12×$\frac{1}{4}$=3、N3-离子数目为8×$\frac{1}{8}$=1,故该晶体的阳离子与阴离子个数比为3:1,由化合价代数和为0,可知3n-3=0,故n=1,故C正确;
D.晶胞中Xn+可知数目为12×$\frac{1}{4}$=3、N3-离子数目为8×$\frac{1}{8}$=1,故该晶体中N3-与Xn+的个数比为1:3,故D错误;
故选C.
点评 本题考查晶胞结构及计算,注意利用均摊法进行晶胞有关计算,需要学生具有一定空间想象能力,难度中等.


科目:高中化学 来源: 题型:解答题
 (g)+CO2(g)?
(g)+CO2(g)?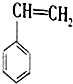 (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
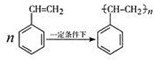 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
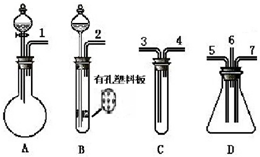 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com