
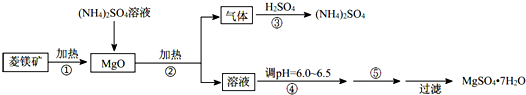
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
| ||
| ||
| 10 -14 |
| 2,24×10 -4 |


科目:高中化学 来源: 题型:
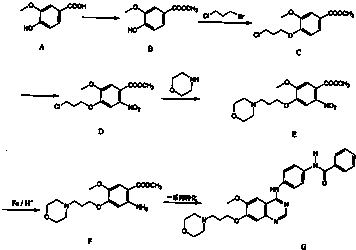
1 |
 )为原料合成对氨基苯甲酸乙酯(
)为原料合成对氨基苯甲酸乙酯(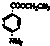 )的合成路线(试剂任选,用合成路线流程图表示)
)的合成路线(试剂任选,用合成路线流程图表示)| HBr |
| NaOH |
| 水/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
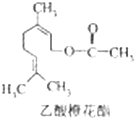 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( ) | A、①②③ | B、①②⑤ |
| C、①②⑤⑥ | D、①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溶液中加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不溶解,则原溶液中一定含有SO42- |
| B、向溶液中滴加浓NaOH溶液并加热,产生的气体能使湿润的蓝色石蕊试液变红,则原溶液中一定含有NH4+ |
| C、向溶液中加入几滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制氯水,溶液变为血红色,该溶液中一定含有Fe2+ |
| D、向溶液中滴加稀盐酸产生无色无味气体,产生的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2 3 |
| O | 2 4 |
| O | 2 3 |
| O | 2- 4 |
| A、①③ | B、②③ | C、③⑤ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b | B、a<b |
| C、a>b | D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com