
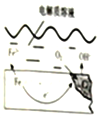
 如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈
如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈分析 (1)钢铁在潮湿空气里发生电化学腐蚀时,铁做负极,发生氧化反应,氧气做正极发生还原反应;
(2)在中性环境中,氧气得电子生成氢氧根离子;
(3)防止金属生锈的方法是:作原电池的正极、电解池的阴极、或使铁与氧气和水隔绝,如在金属表面涂一层油漆、在金属表面镀一层不活泼的金属,形成不锈钢等.
解答 解:(1)上述电化学腐蚀中,铁失电子发生氧化反应,做负极,
故答案为:负;
(2)在中性环境中,氧气得电子生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(3)A.在钢铁制品表面一层金属锌,Zn、Fe形成原电池时,Zn作负极被腐蚀,Fe作正极被保护,能够有效防止或减慢钢铁发生腐蚀,故A正确;
B.将钢铁制品放置在潮湿处,易形成原电池,Fe易发生吸氧腐蚀,故B错误;
C.在钢铁中加入锰,铬等金属,以改变钢铁结构,可以减缓铁的腐蚀,故C正确;
D.在大型铁壳船表面喷涂油漆并订上铜块,Cu与Fe形成原电池时,Fe作负极被腐蚀,所以不能减缓钢铁发生腐蚀,故D错误.
故答案为:AC.
点评 本题考查金属腐蚀与防护,明确原电池原理即可解答,知道钢铁发生析氢腐蚀和吸氧腐蚀的区别,知道防止金属腐蚀的方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中过渡元素可作为催化剂 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 常温常压下,相同体积的O2和O3具有相同的分子数 | |
| D. | F2、Cl2、Br2、I2共价键逐渐增强,熔点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H与D互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n=m+1 | B. | n=m+10 | C. | n=m+11 | D. | n=m+25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使 pH 试纸呈红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH=13的溶液:S2-、SO32-、SO42-、Na+ | |
| C. | 使红色石蕊试纸变蓝色的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 含有溶质为K2SO4的溶液:AlO2-、Na+、Al3+、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Al3+含有的核外电子数为3×6.02×1023 | |
| B. | 将58.5 g NaCl溶于1.00 L水中,所得NaCl溶液的浓度为1.00 mol•L-1 | |
| C. | 2 mol SO2气体与足量的O2在一定条件下反应,转移的电子数为4×6.02×1023 | |
| D. | 常温下,100mL pH=1的硫酸溶液中含有的H+离子数为0.01×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com