
A、 |
B、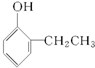 |
C、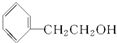 |
D、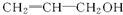 |
科目:高中化学 来源: 题型:
| A、取样,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、取样,加入硝酸银有白色沉淀,一定有Cl- |
| C、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、取样,滴加KSCN溶液,不显红色,再滴加氯水后显红色,一定有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NO2?N2O4 (正反应为放热反应) |
| B、C(s)+CO2?2CO (正反应为吸热反应) |
| C、N2+3H2?2NH3 (正反应为放热反应) |
| D、H2S?H2+S(s)(正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S分子中,S为sp杂化,为直线形 |
| B、BCl3中B原子sp2杂化,为平面三角形 |
| C、CS2中C原子sp杂化,为直线形 |
| D、PCl3中P原子sp3杂化,为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Ba2+、NO3-、Cl- |
| B、H+、Fe2+、ClO-、Cl- |
| C、Na+、Ag+、Cl-、SO42- |
| D、Al3+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学平衡不发生移动 |
| B、化学平衡向正反应方向移动 |
| C、化学平衡向逆反应方向移动 |
| D、正反应速率增大,逆反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com