
【题目】已知有以下物质相互转化: 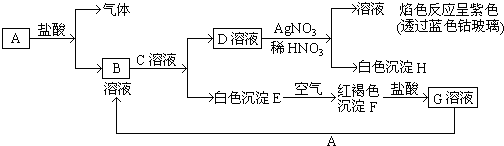
试回答:
(1)写出B的化学式D的化学式 .
(2)写出由E转变成F的化学方程式 .
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式 .
【答案】
(1)FeCl2 ;KCl
(2)4Fe(OH)2+O2+2H2O═4Fe(OH)3
(3)Fe3++3SCN﹣═Fe(SCN)3 ;2Fe3++Fe═3Fe2+
【解析】解:D和硝酸银反应生成白色沉淀H,H不溶于稀硝酸,所以H是氯化银,则D中含有氯离子,D和硝酸银混合溶液进行焰色反应呈紫色,则D中含有钾元素,所以D是氯化钾,白色沉淀E和氧气反应生成红褐色沉淀F,则F是氢氧化铁,E是氢氧化亚铁,氢氧化铁和盐酸反应生成氯化铁溶液,所以G是氯化铁,氯化铁和A反应生成B,B和C反应生成氯化钾和氢氧化亚铁,所以A是铁,B是氯化亚铁,C是氢氧化钾.(1)通过以上分析知,B是氯化亚铁,D是氯化钾,B和D的化学式分别是:FeCl2、KCl,故答案为:FeCl2;KCl;(2)E是氢氧化亚铁,F是氢氧化铁,氢氧化亚铁和氧气、水反应生成氢氧化铁,反应方程式为:4Fe (OH)2+O2+2H2O═4Fe (OH)3 , 故答案为:4Fe (OH)2+O2+2H2O═4Fe (OH)3;(3)铁离子和硫氰根离子反应生成硫氰化铁,离子反应方程式为:Fe3++3SCN﹣═Fe (SCN)3 , 铁离子和铁反应生成亚铁离子,离子反应方程式为:2Fe3++Fe═3Fe2+ , 故答案为:Fe3++3SCN﹣═Fe(SCN)3;2Fe3++Fe═3Fe2+ . D和硝酸银反应生成白色沉淀H,H不溶于稀硝酸,所以H是氯化银,则D中含有氯离子,D和硝酸银混合溶液进行焰色反应呈紫色,则D中含有钾元素,所以D是氯化钾,白色沉淀E和氧气反应生成红褐色沉淀F,则F是氢氧化铁,E是氢氧化亚铁,氢氧化铁和盐酸反应生成氯化铁溶液,所以G是氯化铁,氯化铁和A反应生成B,B和C反应生成氯化钾和氢氧化亚铁,所以A是铁,B是氯化亚铁,C是氢氧化钾.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A.寻找合适催化剂提高合成氨工业中原料的转化率
B.对废旧电池进行回收处理,主要是为了环境保护和变废为宝
C.提高油品质量,可以从一定程度上减少雾霾天气
D.含重金属离子的电镀废液不能随意排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1molL﹣1NaOH溶液.整个实验过程中溶液的pH变化曲线如右图所示,不考虑次氯酸分解,下列叙述正确的是( ) 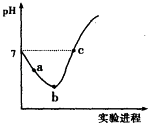
A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中 ![]() 减小
减小
C.b点对应溶液中:c(Cl﹣)>c(H+)>c(HClO)>c(ClO﹣)>c(OH﹣)
D.c点对应溶液中:c(Na+)=2c(ClO﹣)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是( )
金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
A | Mg | 0.1 | 6molL﹣1硝酸 | 10mL | 60℃ |
B | Mg | 0.1 | 3molL﹣1盐酸 | 10mL | 60℃ |
C | Fe | 0.1 | 3molL﹣1盐酸 | 10mL | 60℃ |
D | Mg | 0.1 | 3molL﹣1硫酸 | 10mL | 60℃ |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是
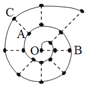
A. 原子半径大小顺序:r (B)>r(C)>r(A)
B. B、C最高价氧化物之间可以相互反应
C. A、C 形成的简单氢化物的稳定性差异是由于氢键作用力较强
D. 虚线相连的元素处于同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是( )
试管 | 温度 | 过氧化氢溶液浓度 | 催化剂 |
A | 常温 | 3% | ﹣﹣ |
B | 水浴加热 | 3% | ﹣﹣ |
C | 水浴加热 | 6% | MnO2 |
D | 常温 | 6% | ﹣﹣ |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO3)是工业盐的主要成分,在漂白、电镀等方面应用广泛。己知: 室温下,2NO+Na2O2= =2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(部分夹持装置已略去)下列说法正确的是
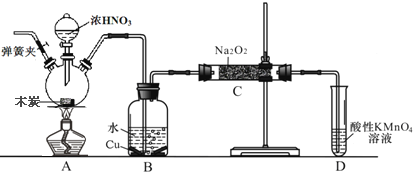
A. 实验开始前先向装置中通入N2,实验结束时先停止通入N2再熄灭酒精灯
B. 可以将B中药品换成NaOH 溶液
C. 应在B、C之间加一个盛放碱石灰的干燥管
D. D装置用于尾气处理,标况下,每吸收11.2L的尾气消耗0.2mol 的高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com