
【题目】某研究小组用如图所示装置制取乙酸乙酯,请回答下列问题:

(1)为防止试管a中液体在实验时发生暴沸,加热前应采取的措施为:_____。
(2)装置中的球形干燥管除起冷凝作用外,它的另一重要作用是_____。
(3)试管b中饱和碳酸钠溶液的作用除了溶解乙醇、降低乙酸乙酯的溶解度外,还有_____。
(4)待试管b收集到一定量产物后停止加热,撤去试管b并用力震荡试管b,静置后试管b中所观察到的实验现象:_____。
(5)图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,其中①②③编号表示适当的分离方法:
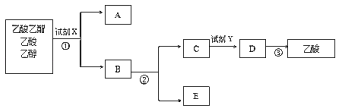
在上述实验过程中,下列说法正确的是_____(填选项)。
A 试剂X为饱和碳酸钠
B 试剂Y可为盐酸
C ①为分液
D ②③均为蒸馏
【答案】加入碎瓷片/沸石 防止倒吸 中和乙酸 分层,上层无色油状液体 ACD
【解析】
(1)乙酸、乙醇沸点低,液体加热要加碎瓷片,可防止溶液暴沸,
故答案为:加入碎瓷片/沸石;
(2)乙酸乙酯中混有乙醇和乙酸,二者易溶于水,乙酸能和碳酸钠反应,易产生倒吸,该实验中使用球形管,球形部分空间大,液面上升时可缓冲,所以球形干燥管B能缓冲液面瞬间上升,作用是防止倒吸,
故答案为:防止倒吸;
(3)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体,即吸收挥发出来的乙酸和乙醇,降低乙酸乙酯的溶解度便于分层析出,试管b中饱和碳酸钠溶液的作用除了溶解乙醇、降低乙酸乙酯的溶解度外,还有中和乙酸,
故答案为:中和乙酸;
(4)乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,有香味,所以静置后,试管b中所观察到的实验现象:b中液体分层,上层是无色有香味的油状液体,
故答案为:分层,上层无色油状液体;
(5)A.乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,试剂X为饱和碳酸钠,故A正确;
B.醋酸钠和乙醇的碳酸钠水溶液是互溶的,其中乙醇的沸点很低,②采用蒸馏的方法将乙醇分离出来;盐酸易挥发,由上述分析可知,试剂Y为H2SO4,故B错误;
C.乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,①为分液,故C正确;
D.上述实验过程中,所涉及的三次分离操作分别是①分液、②蒸馏、③蒸馏,故D正确;
故答案为:ACD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物 Mg5Al3(OH)19(H2O)4 可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据___________。
(2)用离子方程式表示除去固体产物中 Al2O3 的原理___________
(3)已知 MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理_____________。
Ⅱ.磁性材料 A(M=296g/mol)是由两种元素组成的化合物,某研究小组按如图流程探 究其组成:

请回答:
(4)A的化学式为_____。C 中呈黄色的离子对应元素在元素周期表中的位置为__________。
(5)已知化合物 A 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下,该气体对氨气的相对密度为2),该气体分子的电子式为_____。写出该反应的离子方程式_________。
(6)写出F→G反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 g氢气燃烧生成液态水放出142.9 kJ热量,该反应的热化学方程式表示正确的是( )
A. 2H2(g)+O2(g)===2H2O(l) ΔH =-142.9 kJ·mol-1
B. H2(g)+![]() O2(g)===H2O(l) ΔH =-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH =-285.8 kJ·mol-1
C. 2H2+O2===2H2O ΔH =-571.6 kJ·mol-1
D. H2(g)+![]() O2(g)===H2O(g) ΔH = -285.8 kJ·mol-1
O2(g)===H2O(g) ΔH = -285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,等物质的量的A和B发生反应:A(g)+2B(g) ![]() 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A. 40% B. 50% C. 60% D. 70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(1)若电极a为Zn,电极b为石墨
①当电解质溶液为稀硫酸时,该电池的负极的电极反应式为:_____;当反应中收集到标准状况下448mL气体时,电池中所转移的电子数目为_____。
②当电解质溶液为NaCl溶液时,该电池的正极的电极反应式为:_____;反应过程中,Na+移向_____电极(填字母“a”或“b”)。
(2)现设计一燃料电池,以电极a为正极,电极b为负极,甲烷(CH4)为燃料,采用氢氧化钠溶液为电解质溶液,则氧气应通入_____极(填“a”或“b”),另一电极的电极反应式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见金属的冶炼原理不合理的是
A. 还原法炼铝:3H2+Al2O3 ![]() 2Al+3H2O
2Al+3H2O
B. 加热法炼汞:2HgO ![]() 2Hg+O2↑
2Hg+O2↑
C. 铝热法炼铁:Fe2O3+2A ![]() 2Fe+Al2O3
2Fe+Al2O3
D. 火法炼铜:Cu2S+O2 ![]() 2Cu+SO2
2Cu+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于5L的密闭容器中,发生反应:![]() ,经5min后,测得D的浓度为
,经5min后,测得D的浓度为![]() ,
,![]() ,C的平均反应速率是
,C的平均反应速率是![]() 。
。![]() 请写出计算过程
请写出计算过程![]() 求:
求:
![]() 的平均反应速率_____;
的平均反应速率_____;
![]() 的值_____;
的值_____;
![]() 反应开始前放入容器中的A、B的物质的量_____;
反应开始前放入容器中的A、B的物质的量_____;
![]() 时B的物质的量浓度_____。
时B的物质的量浓度_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与ICl的反应分①、②两步进行,其能量变化曲线如图所示,下列有关说法错误的是( )

A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的 ΔH=-218 kJ·mol-1
D.反应①比反应②的速率慢,与相应断键吸收的能量无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com