
【题目】(1)4.8 g O2和0.2 mol CO2,质量之比是 ,在同温同压下的体积之比是 。相同物质的量的SO2和SO3,所含分子的数目之比为 ,所含O原子的物质的量之比为 。
(2)在标准状况下,将224 L HCl气体溶于635 mL水(ρ=1.0 g·cm3)中,所得盐酸的密度为1.18 g·cm3。试计算:
①所得盐酸的物质的量浓度为 。
②取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度为 。
③现用0.1 mol·L1的NaOH溶液中和②中盐酸100 mL,需要NaOH溶液体积为 。
【答案】
(1) 6∶11 3∶4 1∶1 2∶3
(2)①11.8 mol/L ②1 mol/L ③1 L
【解析】
(1)n(O2)=0.15 mol,m(CO2)=0.2 mol×44 g/mol=8.8 g,所以氧气和二氧化碳的质量之比=4.8 g∶8.8 g=6∶11;同温同压下,气体摩尔体积相等,二者的物质的量之比等于其体积之比,所以氧气和二氧化碳的体积之比=0.15 mol∶0.2 mol=3∶4;相同物质的量的二氧化硫和三氧化硫,其分子数之比等于物质的量之比,所以二者的分子数之比为1∶1,每个二氧化硫分子中含有2个O原子、每个三氧化硫分子中含有3个O原子,所以二氧化硫和三氧化硫中O原子的物质的量之比为2∶3。
(2)①标准状况下224 L HCl气体的物质的量是10 mol,质量是365 g,溶剂的质量是635 g,所以溶液的质量是1000 g,则溶液的体积是1000/1.18 mL,所以盐酸的浓度是10 mol÷1/1.18 L=11.8 mol/L。
②由于稀释过程中溶质是不变的,所以稀释后的浓度是11.8 mol/L×0.1 L÷1.18 L=1 mol/L。
③根据反应方程式NaOH+HCl![]() NaCl+H2O知c(HCl) ·V(HCl)=c(NaOH) ·V(NaOH),则V(NaOH)=1 L。
NaCl+H2O知c(HCl) ·V(HCl)=c(NaOH) ·V(NaOH),则V(NaOH)=1 L。


科目:高中化学 来源: 题型:
【题目】下列放热反应的说法中正确的是( )
A. 只要是释放热量的变化就是放热反应
B. 只要是释放热量的化学变化就是放热反应
C. 不需要加热就能反应的化学反应就是放热反应
D. 反应物的总能量小于生成物的总能量的化学反应就是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH(CH2CH3)3的名称是3-甲基戊烷
B. ![]() 和
和![]() 、
、![]() 和
和![]() 都属于同一种物质
都属于同一种物质
C. 乙醛和丙烯醛(![]() )不是同系物,与氢气充分反应后产物也不是同系物
)不是同系物,与氢气充分反应后产物也不是同系物
D. 向苯中加入酸性高锰酸钾溶液震荡后静置,观察到液体分层,且上、下层均无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:

(1)O点导电能力为零的原因是_______________________________。
(2)a、b、c三点中,CH3COOH的电离度最大的是________;a、b、c三点的pH由小到大的顺序是___________CH3COOH的电离平衡常数表达式Ka=________。
(3)若使c点溶液中c(CH3COO-)增大,则下列措施中,可选择________(填字母序号)。
A.加热 B.加入很稀的NaOH溶液
C.加入固体KOH D.加水
E.加入固体CH3COONa F.加入锌粒
(4)在CH3COOH溶液的稀释过程中,始终保持增大趋势的是________(填字母序号)。
A.c(H+) B.H+的个数
C.CH3COOH的分子数 D.c(H+)/c(CH3COOH)
(5)下列有关CH3COOH溶液的说法正确的是________(填字母序号)。
A.CH3COOH溶液中各离子浓度的关系为c(H+)=c(OH-)+c(CH3COO-)
B.向0.10 mol/L的CH3COOH溶液中加水,c(H+)增大
C.CH3COOH溶液中各离子浓度的关系为c(CH3COO-)>c(H+)>c(OH-)
D.常温下,c(H+)=0.01 mol/L的CH3COOH溶液与c(OH-)=0.01 mol/L的NaOH溶液等体积混合后,溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下、相同体积的任何气体都含有相同数目和分子”,他们设计了如下实验装置并记录相关实验数据。
实验装置:
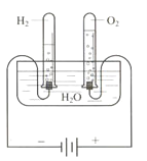
部分实验数据:
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2物质的量分别是 mol、 mol。
(2)该温度下,气体摩尔体积是 。
(3)假设电解H2O速率相同,2分钟时试管内收集到的H2的体积是 mL。
(4)根据以上实验得出如下结论,其中不正确的是 。
A. 气体摩尔体积与气体的温度相关
B. 在该实验条件下,3 mol O2的气体摩尔体积为74.58 L/mol
C. 同温、同压下,2 mol O2和2 mol CO和CO2混合气体的体积相同
D. 该实验条件下,O2的密度为1.287 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. M﹣空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e﹣=4OH﹣
D. 比较Mg、Al、Zn三种金属﹣空气电池,Mg﹣空气电池的理论比能量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物都是形成雾霾天气的重要因素。下列方法可处理氮氧化物和硫氧化物。
(1) 用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,在一定条件下,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ/mol。
N2(g)+CO2(g) ΔH=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 |
NO | 1.00 | 0.58 | 0.40 | 0.40 |
N2 | 0 | 0.21 | 0.30 | 0.30 |
CO2 | 0 | 0.21 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)=_____________,T1℃时,该反应的平衡常数K= _____________。
②若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2∶1∶1,则Q_____________ (填“>”、“=”或“<”) 0。
(2) NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。

①由图甲可知,SCR技术中的氧化剂为_____________。已知 NH3氧化时发生如下反应:
4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH2=-1811.63kJ·mol-1
则氨气被氧化为氮气和水蒸气的热化学方程式:_______________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂及相应的温度分别为___________、___________。
(3) 烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,若所得溶液呈中性,则该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
(4) 某研究小组用NaOH溶液吸收二氧化硫后,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图丙所示,电极材料为石墨。

丙
①a表示_______(填“阴”或“阳”)膜。A-E分别代表原料或产品,其中C为稀硫酸,则A为____________溶液(填写化学式)。
②阳极电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同温度和压强下,等质量的SO2和O2。二者体积比为________,分子个数比为________,密度比为________。
(2)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际上至今发现具有巨磁电阻效应的20多种金属纳米多层膜中,其中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如右图),有关说法正确的是( )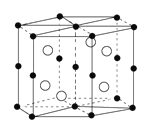
A.锰价电子排布为3d74s0
B.Bi是d区金属
C.该晶体的化学式为MnBi
D.该合金堆积方式是简单立方
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com