
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的还原性为H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | L、M、R的最高价氧化物的水化物两两之间均能反应 | |
| D. | 离子半径:L2+<R2- |
分析 短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素,结合元素周期律及元素化合物性质解答.
解答 解:短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素.
A.非金属性O>S,元素的非金属性越强,对应氢化物的还原性越弱,故A错误;
B.金属性Mg>Be,则Mg与酸反应越剧烈,故B错误;
C.L、M、R的最高价氧化物的水化物分别为氢氧化镁、氢氧化铝、硫酸,氢氧化铝不能与氢氧化镁反应,故C错误;
D.Mg2+离子比S2-离子少1个电子层,故离子半径:Mg2+<S2-,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,学生能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 将固体熟石灰和氯化铵混合加热 | |
| B. | 加热试管中的氯化铵固体 | |
| C. | 将烧瓶中的浓氨水加热 | |
| D. | 将分液漏斗中的浓氨水滴入装有碱石灰的烧瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的溶液 | B. | 能与金属Al反应放出H2的溶液 | ||
| C. | 遇酚酞显无色的溶液 | D. | c(H+)>c(OH-)的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
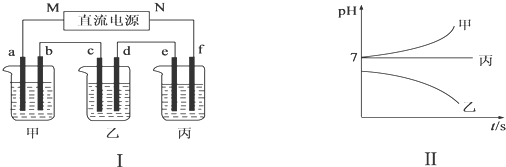
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中共转移3 mol电子 | B. | 反应中共消耗1.8 mol H2SO4 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 气体甲中SO2与H2的体积比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 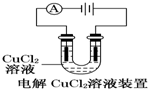 装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝 | |
| B. | 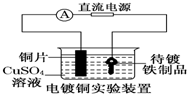 装置中待镀铁制品应与电源正极相连 | |
| C. |  装置中电子由b极流向a极 | |
| D. |  装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
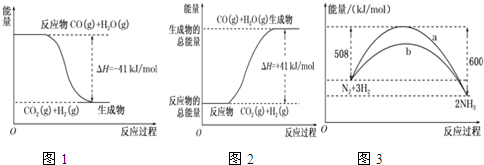
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、OH-、Cl-、NH4+ | B. | Na+、K+、HSO3-、Cl-. | ||
| C. | K+、Na+、S2-、NO3-. | D. | Na+、Al3+、Cl-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com