
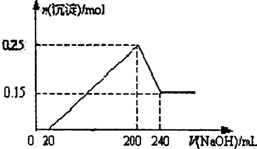
| A.当加入氢氧化钠溶液体积为20mL时,溶液的pH等于7 |
| B.当加入氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝 |
| C.NaOH溶液的物质的量浓度为2.5 mol/L |
| D.生成的H2在标准状况下的体积为11.2L |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:不详 题型:单选题
| A.该物质属于两性氢氧化物 | B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+ | D.该药剂不适合于胃溃疡患者服用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1︰2 | B.1︰3 | C.3︰2 | D.1︰1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
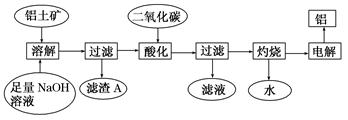
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,含有杂质
,含有杂质 、
、 、
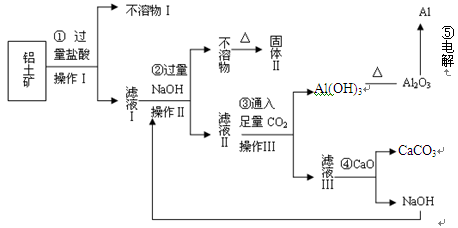
、 。工业上从铝土矿中提取铝可采用如下工艺流程:
。工业上从铝土矿中提取铝可采用如下工艺流程: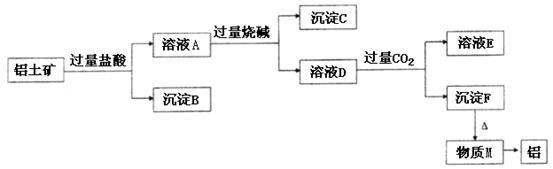
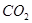 生成沉淀F的离子方程式为________________________。
生成沉淀F的离子方程式为________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.复分解反应 | B.氧化还原反应 | C.置换反应 | D.分解反应 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com