
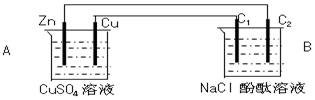
 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题分析 该装置中A能自发的进行氧化还原反应为原电池,B为电解池,锌易失电子作负极,铜作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电,根据串联电路中得失电子守恒计算.
解答 解:(1)A能自发的进行氧化还原反应,能将化学能转化为电能,活泼性较强的Zn为负极,电极反应式为Zn-2e-=Zn2+;故答案为:负;Zn-2e-=Zn2+;
(2)活泼性较弱的Cu为正极,石墨棒C1与正极相连为阳极,阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2;石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,所以阴极附近有气泡,溶液变红,
故答案为:阳;2Cl--2e-=Cl2;有气泡,溶液变红;
(3)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则转移的电子为0.02mol,Zn电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g,此时装置B中OH-的物质的量为0.02mol;
故答案为:0.65;0.02.
点评 本题考查了原电池和电解池原理,正确判断原电池和电解池的电极反应是解本题关键,难点是电极反应式的书写和电子守恒的应用,难度不大.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小:W>Z>X | |
| B. | 气态氢化物的还原性:Y>M | |
| C. | 最高价氧化物的水化物的酸性:M>W | |
| D. | X与Y可形成10电子分子和18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | CuCl2 | C. | NaOH | D. | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 | |
| B. | 有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| C. | 有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 | |
| D. | 有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | Pt4+提供孤对电子 | |
| C. | Cl-和NH3分子均与Pt4+配位 | |
| D. | 配合物中Cl-与Pt4+配位,而NH3分子不配位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量 | |
| B. | 检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热 | |
| C. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| D. | 做锌铜稀硫酸原电池实验时,反应一段时间后锌片表面还是呈银白色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com