
| A. | 硫酸、纯碱、石膏、铁红 | B. | 醋酸、烧碱、纯碱、生石灰 | ||
| C. | 碳酸、熟石膏、小苏打、三氧化硫 | D. | 氯化氢、苛性钠、氯化钠、石灰石 |
分析 酸是指电离时生成的阳离子全部是氢离子的化合物;
碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
盐是指由金属离子和酸根离子组成的化合物;
氧化物是由两种元素组成,并且一种元素是氧元素的化合物.
解答 解:A.纯碱为碳酸钠属于盐,故A错误;
B.醋酸为酸,烧碱为氢氧化钠为碱,纯碱为碳酸钠为盐,生石灰为氧化钙为氧化物,故B正确;
C.碳酸为酸,熟石膏是硫酸钙为盐,小苏打为碳酸氢钠为盐,三氧化硫为氧化物,故C错误;
D.氯化氢为酸,苛性钠是氢氧化钠为碱,氯化钠是盐,石灰石主要成分为碳酸钙不是氧化物,故D错误;
故选B.
点评 本题考查酸、碱、盐、氧化物的判别,了解常见物质的组成、抓住各概念的特征进行分析判断是解答此类题的关键,采用排除法是正确、快速解答此类题的捷径,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 过量的铁与浓硝酸 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18mol/L硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Al+3Cl2↑ | B. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ | ||
| C. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
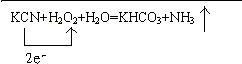 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与足量二氧化碳反应转移的电子数为2 NA | |
| B. | 标准状况下22.4L CCl4所含的原子数为5NA | |
| C. | 56g Fe与任何物质完全反应时转移的电子数一定为2NA | |
| D. | 1mol镁与足量氧气或氮气反应均失去2NA的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②③ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
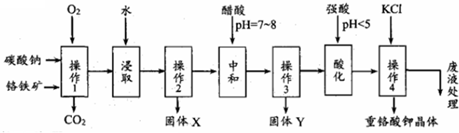
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若AgCl沉淀完全,就是指氯化银溶液中溶质离子的浓度为零 | |
| B. | 达到溶解平衡时,晶体就不再溶解 | |
| C. | 室温下,在100g水中能溶解1~10g的溶质,这种物质被称为可溶性物质 | |
| D. | 无机酸都是可溶的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com