
| A、利用1mol/L FeCl3溶液制得氢氧化铁胶体的胶粒数目一定小于1NA |
| B、10L 18.4mol?L-1硫酸与64g铜加热反应,生成SO2分子的数目一定小于1NA |
| C、通常状况下,22.4L氯气与烧碱溶液完全反应,转移电子数目一定小于1NA |
| D、标准状况下,22.4LHF所含分子数为1NA |


科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | ||
| B、S(s)+O2(g)=SO2(g);△H1 S(g)+O2(g)=SO2(g);△H2 | ||
C、CO(g)+
| ||
| D、NaOH(aq)+HCl (aq)=NaCl(aq)+H2O;△H1 NaOH(aq)+CH3COOH (aq)=CH3COONa (aq)+H2O;△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴苯中混有溴,有汽油箤取出溴 |
| B、硝基苯中混有浓HNO3和浓H2SO4,将其倒入到NaOH溶液中,静置,分液 |
| C、乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷 |
| D、乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1溶液中:K+、Mg2+、AlO2-、S2O32- | ||
| B、Na2S溶液中:SO42-、K+、Cl-、Cu2+ | ||
C、
| ||
| D、含Fe2+溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,Al与浓硫酸接触无明显现象,是由于Al与浓硫酸不反应 |
| B、SO2水溶液和氯水均具有漂白性,两者混合漂白性将增强 |
| C、已知相同温度下Ksp(BaSO4)<Ksp(BaCO3),故BaSO4无法转化为BaCO3 |
| D、CO2气体通入Na2SiO3溶液中产生白色沉淀,可说明碳元素的非金属性比硅元素强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、SO42-、Na+、SiO32- |
| B、Ag+、Fe3+、Cl-、SO42- |
| C、K+、SO42-、Mg2+、NO3- |
| D、H+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
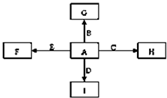 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的| 高温 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
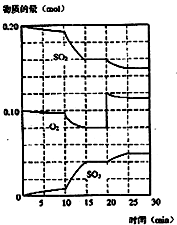 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 |
查看答案和解析>>
科目:高中化学 来源: 题型:
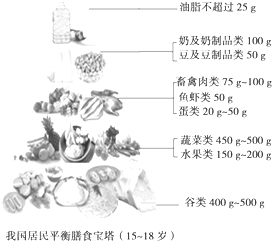 《2011中国居民膳食指南》,该书由一般人群膳食指南、特定人群膳食指南和平衡膳食宝塔三部分组成.仔细研究中国居民平衡膳食宝塔,回答以下问题.
《2011中国居民膳食指南》,该书由一般人群膳食指南、特定人群膳食指南和平衡膳食宝塔三部分组成.仔细研究中国居民平衡膳食宝塔,回答以下问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com