
| A. | 酚遇FeCl3溶液时立即显紫色,而醇不能 | |
| B. | 分子内有苯环和羟基的化合物一定是酚 | |
| C. | 含有羟基的化合物一定是醇 | |
| D. | 酚和醇具有相同的官能团,因而具有相同的化学性质 |
分析 A、酚羟基遇氯化铁显紫色;
B、酚是-OH直接连在苯环上的有机物;
C、醇和酚的官能团均为-OH;
D、-OH连在苯环上时,苯环会使-OH活化.
解答 解:A、酚羟基遇氯化铁显紫色,而醇遇氯化铁无现象,故A正确;
B、酚是-OH直接连在苯环上的有机物,当分子中含苯环时,若-OH直接连在苯环上,则是酚,但若-OH连在苯环侧链上,则是醇,故B错误;
C、醇和酚的官能团均为-OH,故含-OH的化合物不一定是醇,还可能是酚,故C错误;
D、-OH连在苯环上时,苯环会使-OH活化,故酚羟基比醇羟基活泼性质不同,故D错误.
故选A.
点评 本题考查醇和酚的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该题的关键,难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 分子式为C14H18N2O3 | |
| B. | 水解产物中有两种氨基酸 | |
| C. | 在一定条件下既能与酸反应又能与碱反应 | |
| D. | 分子中有苯环、氨基、羧基、肽键和酯的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
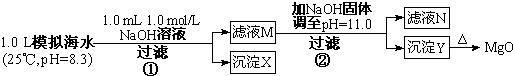
| 模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 7.8g过氧化钠晶体中含有0.1NA个O${\;}_{2}^{2-}$ | |
| C. | 标准状况下,22.4LNO2中含有NA个NO2分子 | |
| D. | 1mol•L-1NH4Cl溶液中,NH${\;}_{4}^{+}$的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
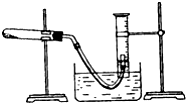 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com