
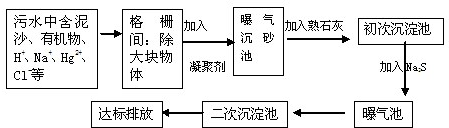
分析 (1)漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,能进行杀菌消毒漂白;
(2)硬水软化的方法通常有①热煮沸法②药剂软化法③蒸馏法④离子交换法⑤电渗析法⑥离子膜电解法;硬水加热后产生碳酸盐沉淀的反应是暂时硬度的水加热软化,碳酸氢钙、碳酸氢镁受热分解;
(3)①在净水时使用的絮凝剂是明矾;
②熟石灰的成分是氢氧化钙,能中和酸性废水;
③污水中有Hg2+离子,可用Na2S除去.
解答 解:(1)碳酸酸性强于次氯酸,漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,能进行杀菌消毒漂白,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(2)把天然水分为硬水和软水.硬水软化法有加热法、药剂法和离子交换法,
故答案为:离子交换法;2Ca(HCO3)2═CaCO3↓+H2O+CO2↑或2 Mg(HCO3)2═MgCO3↓+H2O+CO2↑;
(3)①明矾溶于水形成的胶体具有吸附不溶性悬浮固体颗粒的作用,是净水时常用的絮凝剂,
故答案为:明矾;
②熟石灰的成分是氢氧化钙,能中和酸性废水,化学方程式为Ca(OH)2+2HCl=CaCl2+H2O,
故答案为:中和酸性废水;
③污水中有Hg2+离子,可与Na2S反应生成硫化汞沉淀除去,故答案为:除去Hg2+.
点评 本题考查混合物分离提纯及污水处理,为高频考点,把握物质的性质及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,注重化学与生活的关系,题目难度不大.


科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:选择题
下列有关方程式书写正确的是
A.FeCl2溶液中加入氯水的离子方程式:Fe2++ Cl2=Fe3++2Cl-
B.食醋与NaOH反应的离子方程式:H++OH-=H2O
C.CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.Na2O2与水反应的离子方程式:2O22-+ 2H2O = 4OH-+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示.
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和2-甲基-2-戊烯无论以什么比例混合,只要总质量一定,完全燃烧后生成CO2的质量就一定 | |
| B. | 乙烯和环丁烷(C4H8)分子间相差两个CH2原子团,故它们互为同系物 | |
| C. | 1 mol 乙烯与Cl2完全加成后再与Cl2发生最大程度的取代,两个过程共需Cl26 mol | |
| D. | 以乙烯为原料制备的聚乙烯可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用容量瓶配某盐溶液,定容摇匀后发现凹液面最低处低于刻度线,再加水定容 | |
| B. | 萃取后,分液漏斗中的下层液体从下口流出,上层液体从上口倒出 | |
| C. | 向某溶液中加入KSCN溶液变红色,说明该溶液中含有Fe3+ | |
| D. | 某气体通入品红溶液中,溶液褪色,加热后溶液又恢复为红色,说明该气体为SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com