
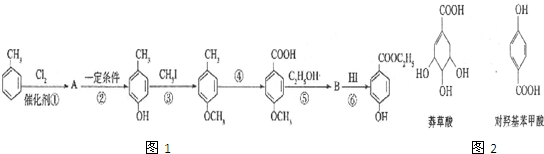
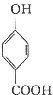
 生成C7H5O3Na的化学反应方程式
生成C7H5O3Na的化学反应方程式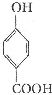 所有同分异构体的结构简式
所有同分异构体的结构简式 和
和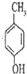 可知,A为
可知,A为 ;
;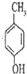 和反应⑥的产物可知,
和反应⑥的产物可知,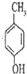 中的甲基被氧化成羧基,而酚羟基也易被氧化,所以反应③的目的是保护酚羟基不被氧化;
中的甲基被氧化成羧基,而酚羟基也易被氧化,所以反应③的目的是保护酚羟基不被氧化;  与乙醇发生酯化反应生成B为
与乙醇发生酯化反应生成B为 ;
; 中有酚羟基和羧基,羧基能与碳酸氢钠反应,而酚羟基则不反应,据此答题;
中有酚羟基和羧基,羧基能与碳酸氢钠反应,而酚羟基则不反应,据此答题; 和
和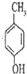 可知,A为
可知,A为 ,
, ;
;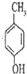 和反应⑥的产物可知,
和反应⑥的产物可知,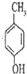 中的甲基被氧化成羧基,而酚羟基也易被氧化,所以反应③的目的是保护酚羟基不被氧化,
中的甲基被氧化成羧基,而酚羟基也易被氧化,所以反应③的目的是保护酚羟基不被氧化, 与乙醇发生酯化反应生成B为
与乙醇发生酯化反应生成B为 ,反应方程式为
,反应方程式为 +CH3CH2OH
+CH3CH2OH| 浓H2SO4 |
| △ |
 +H2O,
+H2O, +CH3CH2OH
+CH3CH2OH| 浓H2SO4 |
| △ |
 +H2O;
+H2O; 中有酚羟基和羧基,羧基能与碳酸氢钠反应,而酚羟基则不反应,所以反应和方程式为
中有酚羟基和羧基,羧基能与碳酸氢钠反应,而酚羟基则不反应,所以反应和方程式为 +NaHCO3→
+NaHCO3→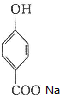 +H2O+CO2↑,
+H2O+CO2↑, +NaHCO3→
+NaHCO3→ +H2O+CO2↑;
+H2O+CO2↑;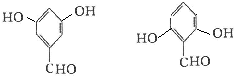 ,
,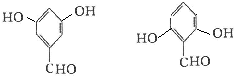 .
.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、32gSO2含有2NA个S=O键 |
| B、0.3 mol NO2与足量水充分反应转移的电子数目为0.2NA |
| C、1 mol碳的同位素中含有6NA个中子 |
| D、25 mL 16.0 mol?L-l浓盐酸与足量MnO2,加热反应,生成Cl2分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:
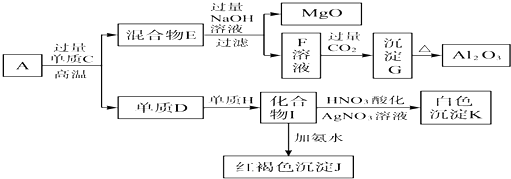
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5Q2-0.5Q3-1.5Q1 |
| B、1.5Q1-0.5Q2+0.5Q3 |
| C、0.5Q1-1.5Q2+0.5Q3 |
| D、0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
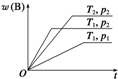 密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B、T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C、T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D、T1>T2,p1>p2,a+b>c,正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在容量瓶中加一定体积的水,再加入浓盐酸配制准确浓度的稀盐酸 |
| B、蒸馏操作时在蒸馏烧瓶中加入沸石以防止爆沸 |
| C、用玻璃棒搅拌漏斗中的液体以加快过滤的速度 |
| D、加入盐酸以除去硫酸钠中的少量碳酸钠杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com