
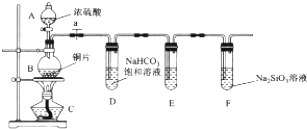
分析 (1)根据装置图中的仪器分析;
(2)反应生成气体,在加入药品之前需要检验装置的气密性;
(3)①多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的实验,反应方程式:5SO2 +2KMnO4+2H2O=K2SO4 +2MnSO4+2H2SO4;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强;
③依据最高价含氧酸的酸性强弱判断非金属性强弱.
解答 解:(1)根据装置图中的仪器可知A为分液漏斗,B为圆底烧瓶,
故答案为:分液漏斗;圆底烧瓶;
(2)反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏,
故答案为:检查装置的气密性;
(3)①多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验,反应方程式:5SO2 +2KMnO4+2H2O=K2SO4 +2MnSO4+2H2SO4,离子方程式为:
5SO2 +2MnO4-+2H2O=5SO4 2-+2Mn2++SO42-+4H+,故答案为:除去SO2气体;5SO2 +2MnO4-+2H2O=5SO4 2-+2Mn2++SO42-+4H+;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:盛有Na2SiO3溶液的试管中出现白色沉淀;
③依据最高价含氧酸的酸性强弱判断非金属性强弱,二氧化硫溶于水生成的是亚硫酸,不是最高价含氧酸,所以不能判断非金属性强弱,试管D中发生反应是二氧化硫与碳酸氢钠生成二氧化碳,其离子方程式为:SO2+2HCO3-=SO32-+H2O+2CO2,
故答案为:否;SO2+2HCO3-=SO32-+H2O+2CO2.
点评 本题考查了非金属性的相对强弱的探究实验,涉及仪器名称,化学方程式的书写,离子方程式的书写,判断非金属性强弱的依据等 考查的知识点较多,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,40gSiC中含有Si-C键的数目为NA | |
| B. | 标准状况下,5.6LO2含有4 NA个电子 | |
| C. | 53.5gNH4Cl中含有H-Cl键的数目为4NA | |
| D. | 25℃时,pH=13的1L Ba(OH)2溶液中含有OH-的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 氨水 | H2SO4 | CH3COOH | 干冰 |
| B | 盐酸 | 氢氧化钠 | H2SO4 | SO2 |
| C | 纯碱 | BaSO4 | H2S | 空气 |
| D | 氢氧化钠溶液 | 石灰石 | 熔融NaCl | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ba2+、HCO3-、Cl- | B. | K+、SO42-、S2-、Cl- | ||
| C. | NH4+、AlO2-、Cl-、OH- | D. | K+、Fe3+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,F是
,F是 .
.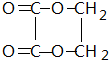 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸中滴加氢氧化钠:H++OH-=H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Ca(HCO3)2溶液与少量KOH溶液反应Ca2++HCO3-+OH-=H20+CaCO3↓ | |
| D. | 向Na2SO3溶液中通入少量氯气:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com