
分析 (1)双线桥中表示同种元素原子之间得失电子情况,2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-;
(2)根据n=$\frac{m}{M}$计算KMnO4的物质的量,根据方程式计算参加反应HCl物质的量、生成氯气物质的量,被氧化的HCl生成氯气,根据氯原子守恒计算被氧化HCl的物质的量,根据V=nV计算生成氯气的体积,根据n=nM计算参加反应HCl的质量、被氧化HCl的质量.
解答 解:(1)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,被氧化,该反应转移10e-,双线桥标出电子的转移方向和数目为: ,
,
答:双线桥标出电子的转移方向和数目为: ;
;
(2)n( KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,
设参加反应HCl的物质的量为x、生成氯气的物质的量为y,则:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 16 5
0.1mol x y
故x=$\frac{0.1mol×16}{2}$=0.8mol,y=$\frac{0.1mol×5}{2}$=0.25mol
标况下生成氯气的体积为0.25mol×22.4L/mol=5.6L,
参加反应HCl的质量为0.8mol×36.5g/mol=29.2g,
被氧化HCl生成氯气,由氯原子守恒可知被氧化HCl的物质的量为0.25mol×2=0.5mol,被氧化的HCl的含量为:0.5mol×36.5g/mol=18.25g,
答:产生标况下的Cl2为5.6升,有29.2克HCl参与反应,其中被氧化的HCl有18.15克.
点评 本题考查氧化还原反应电子转移表示、氧化还原反应计算等,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 将颗粒状锶单质放入水中,反应剧烈,生成大量的气体,气体燃烧且发生轻微爆炸 | |
| B. | 颗粒状锶单质与稀硫酸反应,反应现象不如钠与水反应剧烈 | |
| C. | 锶在纯氧中可以燃烧,燃烧产物与水反应生成的氢氧化物为强碱 | |
| D. | 锶在纯净氮气中可以燃烧,燃烧产物与水反应可以放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Ca、Mg、Al、K | B. | Na、K、Zn、Fe、Hg | C. | Zn、Fe、Cu、Ag、Sn | D. | Mg、Al、Zn、Fe、Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4在医学上用作钡餐,Ba2+ 对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱的多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物鉴定,${\;}_{\;}^{12}$C与${\;}_{\;}^{12}$C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+OH-+2H+═HCO3-↑+H2O | B. | CO32-+2OH-+3H+═HCO3-+2H2O | ||
| C. | CO32-+2OH-+4H+═CO2↑+3H2O | D. | CO32-+OH-+3H+═CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯的结构简式:CH2CH2 | B. | H2O2的结构式:H-0-0-H | ||
| C. | 氮气的电子式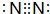 | D. | CH4分子的比例模型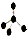 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
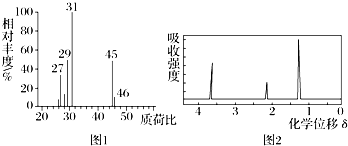
| A. | CH3CH2OH | B. | CH3CHO | C. | HCOOH | D. | CH3CH2CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com