
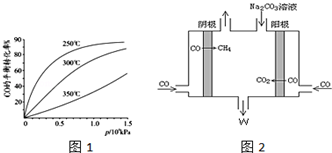
分析 (1)利用盖斯定律计算反应热,得到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;
(2)①图象分析可知压强一定,温度升高CO转化率减小,说明升温平衡逆向进行,逆向是吸热反应,温度在250°一氧化碳转化率高,反应速率大;
②由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体.
解答 解:(1)①NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-56.5kJ•mol-1
②2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
将方程式(②-①×2)×$\frac{1}{2}$得:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ/mol,
a.随反应:NO2(g)+SO2(g)?SO3(g)+NO(g)的进行,气体的质量和物质的量都不变,混合气体的平均相对分子质量始终不变,不能说明到达平衡状态,故a错误;
b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明到达平衡状态,故b正确;
c.随反应进行,SO3和NO都是生成物,所以体积比一直等于系数比,所以SO3和NO的体积比保持不变,不能说明到达平衡状态,故c错误;
d.每生成1molSO3的同时消耗1molNO2都表示逆反应速率,反应自始至终都按此比例进行,故d错误;
故答案为:-41.8;b;
(2)①图象分析可知压强一定,温度升高CO转化率减小,说明升温平衡逆向进行,逆向是吸热反应,正向为放热反应,△H<0,图象分析可知,温度在250°一氧化碳转化率高,反应速率大,
故答案为:<;250;
②由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此离子反应方程式为:4CO+3CO32-+5H2O=6HCO3-+CH4↑,阴极区电极反应式为:CO+6e-+5H2O=6OH-+CH4,
故答案为:CO+6e-+5H2O=6OH-+CH4.
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析能力、计算能力的考查,题目涉及热化学方程式书写,化学平衡影响因素分析判断,原电池原理和电极反应书写方法,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 在阴离子中,质子数一定少于核外电子数 | |
| B. | 氧化反应就是物质与氧气发生的反应 | |
| C. | 在化学反应中加入催化剂一定能加快反应的速率 | |
| D. | 最外层电子数为8的粒子一定是稀有气体元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
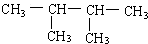 系统命名:2,3-二甲基丁烷
系统命名:2,3-二甲基丁烷
 的分子式:C4H8O
的分子式:C4H8O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)+O2(g)═SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2的键能总和大于1 mol硫和1 mol氧气的键能之和 | |
| D. | 1 mol SO2的键能总和小于1 mol硫和1 mol氧气的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
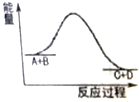
| A. | 该反应为吸热反应 | |
| B. | 该反应只有在加热的条件下才能进行 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应物中的化学键断裂要放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸酸化的BaCl2溶液来判断亚硫酸钠固体是否发生变质 | |
| B. | 加入硝酸银溶液看是否产生白色沉淀来判断溶液中是否有氯离子 | |
| C. | 可加入足量的铜粉然后过滤来除去氯化亚铁溶液中的少量氯化铁 | |
| D. | 加入澄清石灰水看是否有白色沉淀来区别碳酸钠溶液和碳酸氢钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com