
(14分)CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206 kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
CO(g)+3H2(g) △H = +206 kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式 。
②该反应的△S 0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
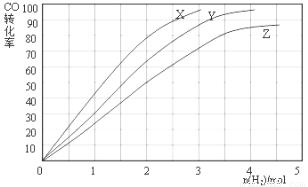
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是 (填字母);理由是 。列式计算270℃时该反应的平衡常数K: 。
(1)0.03mol/(Lmin);AC;
(2)CO(g)+2H2(g)CH3OH(l)△H=-90.8 kJmol-1; < 低温
(3)X
该反应是放热反应,温度越低转化率越高; K=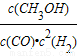 =
= =1.
=1.
【解析】
试题分析:(1)5min内CO的平均化学反应速率v=△c/△t=0.1mol/(2L×5min)= 0.01mol/(Lmin), 氢气表示的平均反应速率是一氧化氮的3倍,即为0.03mol/(Lmin);
根据反应CH4(g)+H2O(g)CO(g)+3H2(g) △H = +206 kJ·mol-1
A.加热升高温度,化学平衡正向移动,所以一氧化碳浓度增加,甲烷浓度减小,所以比值会增大,故A正确;
B.恒温恒容下充入氦气,各组分的浓度不变,所以平衡不移动,比值不变,故B错误;
C.恒温下增大容器体积则压强减小,化学平衡正向移动,所以一氧化碳浓度的减少量少于甲烷浓度减小量,所以比值会增大,故C正确;
D.恒温恒容下再充入等物质的量的CH4和H2O,相当于增大压强,化学平衡逆向动,所以一氧化碳浓度增加量少于甲烷浓度增加量,所以比值会减小,故D错误;
(2)①已知: ① CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
② CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
CO和H2制取甲醇的热化学方程式可以经过①-②得到,所以该反应的焓变
△H=(-49.5kJmol-1 )-(+41.3kJmol-1)=-90.8kJmol-1,
所以CO和H2制取甲醇的热化学方程式:CO(g)+2H2(g)CH3OH(l) △H=-90.8 kJmol-1
②该反应气体分子数减少为熵减即△S<0,放热反应即△H<0,由△G=△H-T△S可得:低温下有利于反应的自发进行。
(3)合成甲醇是放热反应,温度越低CO转化率越大,结合图象可知,230℃的实验结果所对应的曲线是X;270℃时该反应的平衡常数K=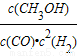 =
= =1
=1
考点:解化学反应速率的概念、反应速率的定量表示方法。 了解化学平衡常数的含义,能利用化学平衡常数进行相关计算。 理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高二上学期期末化学试卷(解析版) 题型:填空题
(12分)T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。
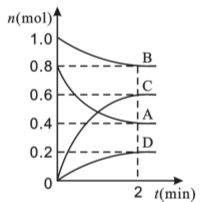
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
在“空气质量日报”中,不被列入首要污染物的是
A.二氧化硫 B.氮氧化物 C.可吸入颗粒物 D.二氧化碳
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
用NaOH固体配制一定物质的量浓度的溶液200 mL,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是

查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于NaCl的说法不正确的是
A.给NaCl溶液通电,使NaCl发生电离
B.NaCl是电解质
C.NaCl电离的方程式是:NaCl== Na+ +Cl
D.NaCl溶液能导电,是因为溶液中有自由移动的离子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷
B.三硝基甲苯的分子式为C7H5N3O6
C.硬脂酸甘油酯和油酸甘油酯互为同系物
D.淀粉与纤维素的化学式为(C6H10O5)n,但两者不是同分异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 molL-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法错误的是
A.若8>m>3,则X必定为主族元素
B.若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X
C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子
D.若a=b=3,8>m>n>b,则元素非金属性:X>Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:

以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)
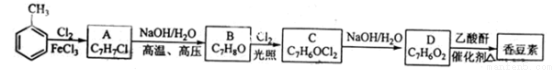
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的化学名称为__________;
(2)香豆素的分子式为_______;由甲苯生成A的反应类型为___________;
(3)B的同分异构体中含有苯环的还有_____种,其中在核磁共振氢谱中只出现四组峰的有_____种;
(4)由B生成C的化学反应方程式为___________;
(5)D的同分异构体中含有苯环的还有______种,其中:既能发生银境反应,又能发生水解反应的是________(写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com