
 2Fe2����aq����I2��aq����Ӧ��ƽ�ⳣ������ʽΪKc= ________ .��������Ӧ�ﵽƽ�����CCl4��ȡI2���¶Ȳ��䣬����ƽ����_________ ����������ҡ����䡱���ƶ���
2Fe2����aq����I2��aq����Ӧ��ƽ�ⳣ������ʽΪKc= ________ .��������Ӧ�ﵽƽ�����CCl4��ȡI2���¶Ȳ��䣬����ƽ����_________ ����������ҡ����䡱���ƶ���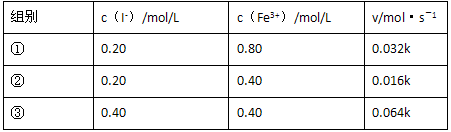

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| FeO | 2- 4 |
| O | - 4 |
| O | - 4 |
| O | 2- 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�긣��ʡ���Ŵ�ѧ�����Ƽ���ѧ�߶���ѧ�����п���ѧ������������ ���ͣ������
�����£���25 mL 0.1 mol/L MOH��Һ����μ���0.2 mol/L HA��Һ��������ͼ��ʾ������仯���Բ��ƣ����ش��������⣺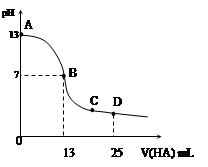
��1��д��MOH��ˮ��Һ�еĵ��뷽��ʽ
��2��MOH��HAǡ����ȫ��Ӧʱ����Һ��_____�ԣ���ᡱ��������С����������ǣ������ӷ���ʽ��ʾ��__ _____����ʱ�������Һ����ˮ�������c(H+)__ _ 0.2 mol/L HA��Һ����ˮ�������c(H+)���������������=������
��3��д��B������Һ�и�����Ũ�ȵĴ�С��ϵ_________ _��
��4��D��ʱ����Һ��c(A��)+c(HA)________2 c(M+)���������������=����������ʱ��û����Һ��pH = 3���� c(HA) + c(H+) = __________mol/L�����ֱ���ʽ�����ؾ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�����и�����ǰģ�⻯ѧ�Ծ��������棩 ���ͣ�������
�����仯�����ڹ��õķ�չ��������Ҫ���á�
��1����֪��4Fe(s)��3O2(g)=2Fe2O3(s) ��H����1641.0kJ��mol-1 C(ʯī)��1/2O2(g)=CO(g) ��H����110.5 kJ��mol-1��Fe2O3(s)��3C(ʯī)=2Fe(s)��3CO(g)�ġ�H�� kJ��mol-1��
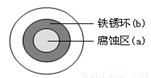
��2�����ڳ�ʪ�Ŀ����������绯ѧ��ʴ��ijͬѧ��NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�Բ��������(a)�ѱ���ʴ���䰵����Һ�������γ���ɫ���(b)����ͼ��ʾ��Һ�α�Ե�� �����������������������缫��ӦʽΪ ��
��3�����ѺϽ���һ�ֳ��õIJ���ֲ��ϣ�ijͬѧ��̽���úϽ������ʱ��������TiO2+��Fe3+��Һ�м�����м����Һ����ɫ���ù����з����ķ�Ӧ�У�
��2TiO2��(��ɫ)��Fe��4H��=2Ti3��(��ɫ)��Fe2����2H2O
��Ti3��(��ɫ)��Fe3����H2O= TiO2��(��ɫ)��Fe2����2H��
�� ��
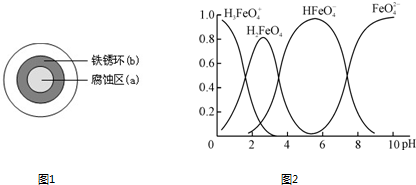
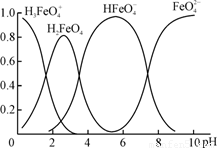
��4���ٸ������(K2FeO4)��һ��������ˮ��������FeO��ˮ��Һ�еĴ�����̬����ͼ��ʾ���������ʾ��������̬�ķ����ֲ���
����˵������ȷ���� ��������ĸ��
A��������Һ�������α仯����Ԫ�ض���4�ִ�����̬
B����pH��10��������Һ�м�������pH��2��HFeO�ķֲ�����������
C����pH��6��������Һ�м�KOH��Һ��������Ӧ�����ӷ���ʽΪ��
HFeO��OH��=FeO��H2O
��K2FeO4����ˮ��ų�һ����ɫ��ζ���壬��ɱ������������ˮ�е��������ʵ�ԭ���������ӷ���ʽ��ʾΪ ��
��5����һ������Fe��FeO��Fe3O4�Ļ�����м���100 mL 1 mol��L-1�����ᣬǡ��ʹ�������ȫ�ܽ⣬�ų�224 mL����״�������壬����KSCN��Һ���Ժ�ɫ������������CO�ڸ����»�ԭ��ͬ�����Ĵ˻����ɵ��� g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�츣��ʡ�����и߶���ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ������
�����£���25 mL 0.1 mol/L MOH��Һ����μ���0.2 mol/L HA��Һ��������ͼ��ʾ������仯���Բ��ƣ����ش��������⣺

��1��д��MOH��ˮ��Һ�еĵ��뷽��ʽ
��2��MOH��HAǡ����ȫ��Ӧʱ����Һ��_____�ԣ���ᡱ��������С����������ǣ������ӷ���ʽ��ʾ��__ _____����ʱ�������Һ����ˮ�������c(H+)__ _ 0.2 mol/L HA��Һ����ˮ�������c(H+)���������������=������
��3��д��B������Һ�и�����Ũ�ȵĴ�С��ϵ_________ _��
��4��D��ʱ����Һ��c(A��)+c(HA)________2 c(M+)���������������=����������ʱ��û����Һ��pH = 3���� c(HA) + c(H+) = __________mol/L�����ֱ���ʽ�����ؾ�����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com