
| c2(CO2) |
| c(O2) |
| c2(CO2) |
| c(O2) |
 ��
�� ��
��

 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Һ�п��ܴ�������Na+��K+��Cl-��HCO3- |
| B��������Һ�п��ܴ�������Na+��ClO-��SO42-��I- |
| C����������c��H+��=1��10-13 mol?L-1����Һ���ܴ�������Mg2+��Cu2+��SO42-��NO3- |
| D�����������ܲ�����������Һ�д�������NH4+��Fe2+��SO42-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ĵ���ƽ�ⳣ���Ƚ�ͬ��ͬ���ʵ���Ũ����ǿ����������Һ�ļ���ǿ�� |
| B��������pH=2�����ᡢ�Ȼ��������Һ�У�ˮ�ĵ���̶���ͬ |
| C���û�ѧ��Ӧƽ�ⳣ���ƶϸû�ѧ��Ӧ�ľ��ҳ̶� |
| D�������������pH������������Һ�Ͱ�ˮ��Һ�ֱ�ϡ����ͬ��������ˮ��pH�仯�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NO2��SO2��NO��SO3������������ʵ���Ũ��֮��Ϊ1��1��1��1 |
| B������n molSO2ͬʱ��n mol SO3���� |
| C��Kֵ���ٷ����仯 |
| D���ܱ�������������ܶȲ��ٷ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
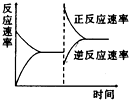 ��ͼ�ǹ��ڷ�ӦA2��g��+3B2��g��?2C��g��������ӦΪ���ȷ�Ӧ����ƽ���ƶ�ͼ��Ӱ��ƽ���ƶ���ԭ������ǣ�������
��ͼ�ǹ��ڷ�ӦA2��g��+3B2��g��?2C��g��������ӦΪ���ȷ�Ӧ����ƽ���ƶ�ͼ��Ӱ��ƽ���ƶ���ԭ������ǣ�������| A�������¶ȣ�ͬʱ��ѹ |
| B�������¶ȣ�ͬʱ��ѹ |
| C������Ӧ��Ũ�ȣ�ͬʱ��С������Ũ�� |
| D������Ӧ��Ũ�ȣ�ͬʱʹ�ô��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
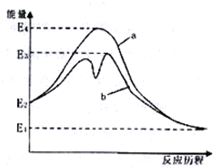 ��ͼ��ʾ������ij��Ӧ��ܵ�Ӱ�죮������ĵ��볣�����£�HClO Kw=2.95��10-8��
��ͼ��ʾ������ij��Ӧ��ܵ�Ӱ�죮������ĵ��볣�����£�HClO Kw=2.95��10-8��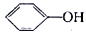 Kw=1.02��10-10H2CO3 Ka1=4.30��10-7 Ka2=5.61��10-11����ͼ��������жϣ�����˵��������ǣ�������
Kw=1.02��10-10H2CO3 Ka1=4.30��10-7 Ka2=5.61��10-11����ͼ��������жϣ�����˵��������ǣ�������| A��ͼ˵���˴������뻯ѧ��Ӧ���������˻�� |
| B��ͼ�и÷�Ӧû�д�������ʱ���ΪE2-E1 |
| C��������CO2ͨ��NaClO��Һ�У��������·�ӦNaClO+CO2+H2O�THClO+NaHCO 3 |
D����ͬŨ�ȵ�NaClO��Һ��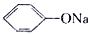 ��Һ��ǰ��pHС ��Һ��ǰ��pHС |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Һ��H+��Na+��NO3-��Cl- |
| B��ʹ���ȱ��ɫ����Һ��Mg 2+��K+��Cl-��I- |
| C��������C2H2��CO2��SO2��NO |
| D�����������Һ��H+��Na+��SO42-��NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ | B����ѹ |
| C����ˮϡ�� | D���μ�Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com