
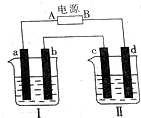
 如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:
如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:分析 (1)在电解池中,阳极上发生失电子的氧化反应,阴极上发生的电子的还原反应,根据离子的放电顺序以及电极反应现象确定电极,根据电极反应式结合电子转移情况进行计算;
(2)据钾盐的质量、钾元素的百分含量以及钾元素和硫元素物质的量关系计算钾元素以及硫元素的物质的量,根据质量守恒,计算氧元素的物质的量,物质的量之比等于原子个数之比,确定分子式,根据电解池的阳极、阴极离子的放电顺序以及工作原理书写电极反应式.
解答 解:(1)Ⅰ中是Cu(NO3)2溶液,a电极产生0.56L(标准状况下)气体,说明是电解池的阳极,和电源的正极相连,则A为电源的正极,阳极上发生反应:4OH--4e-
O2↑+2H20,阴极反应:Cu2++2e-=Cu,m[Cu(NO3)2]=200g×9.4%=18.8g,n[Cu(NO3)2]=0.1mol,0.1mol铜离子得电子的物质的量是0.2mol,根据阳极上的反应,产生氧气的物质的量是$\frac{5.6L}{22.4L/mol}$=0.025mol,转移电子是0.1mol,据Cu2++2e-=Cu,所以析出金属铜0.05mol,溶液的质量=200g-0.05mol×64g/mol-0.025mol×32g/mol=196g,故答案为:正;196;
(2)钾盐晶体(不含氢元素)摩尔质量为238 g•mol-1,该盐中钾的含量为32.8%,则n(K)=$\frac{238×32.8%}{39}$=2mol,且钾与硫元素原子的物质的量之比为1:1,则n(S)=2mol,所以n(O)=$\frac{238-2×39-2×32}{16}$=6,化学式为:K2S2O6,d电极是电解池的阴极,发生还原反应,电极反应为:2H++2e-=H2↑,c为阳极,发生失电子的氧化反应,即2SO32--2e-=S2O62-,故答案为:K2S2O6;2H++2e-=H2↑;2SO32--2e-=S2O62-.
点评 本题考查学生电解池的工作原理知识,借助分子式的确定为载体设计电解池的有关计算增加了试题的难度,综合性较强.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
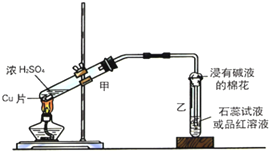 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 镁必须密封保存在容器中,防止镁跟空气中的氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
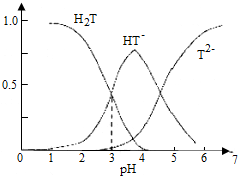
| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ | |
| B. | 2NH4Cl+6HCl+K2Cr2O7═2KCl+N2↑+2CrCl3+7H2O | |
| C. | 3Br2+6NaOH═NaBrO3+5NaBr+3H2O | |
| D. | 5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
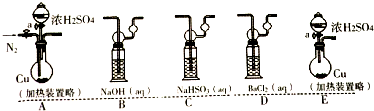
| 溶液 | ①品红溶液 | ②Na2S | ③BaCl2 | ④Ba(OH)2 | ⑤Ba(NO3)2 |
| 现象 | 溶液褪色 | 黄色沉淀 | 无明显现象 | 白色沉淀 | 白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com