
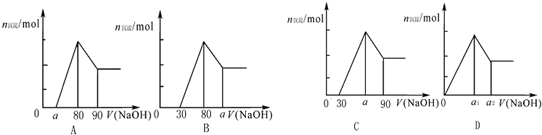
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中不正确的是

图A 图B 图C
A.![]() 的取值范围为 0≤a<50
的取值范围为 0≤a<50
B.![]() 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则![]() 的取值范围为80<a<90
的取值范围为80<a<90
D.若将关系图改为C图时,则![]() 的取值范围为75<a<90
的取值范围为75<a<90
C
本题考查元素化合物的知识。根据图A可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀2种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、最后是Al(OH)3的溶解:Al(OH)3+OH-=AlO2-+2H2O。从横坐标80mL到90mL这段可以求出n(Al(OH)3)=0.01mol,则n(Al)= n(Al(OH)3)=0.01mol,所以沉淀Al3+需要的OH-为0.03mol,即NaOH溶液的体积为30mL,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,求出n (Mg)的最大值为0.025mol,这种情况下,酸恰好与合金反应完全,即![]() =0,
=0,![]() 的最大值为2.5,B选项正确;通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图A可知,中和过量的酸所消耗的碱液体积为50mL,所以
的最大值为2.5,B选项正确;通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图A可知,中和过量的酸所消耗的碱液体积为50mL,所以![]() 的最大值为50,但是最大值是不存在的,所以
的最大值为50,但是最大值是不存在的,所以![]() 的取值范围为 0≤a<50,A选项正确;将关系图改为B图时,说明沉淀Mg2+、Al3+所需要碱液的体积为50mL,假设合金中完全是金属镁,则产生的沉淀不溶解,则
的取值范围为 0≤a<50,A选项正确;将关系图改为B图时,说明沉淀Mg2+、Al3+所需要碱液的体积为50mL,假设合金中完全是金属镁,则产生的沉淀不溶解,则![]() =80,假设合金中完全是金属铝,则n(Al3+)= n(Al(OH)3)=
=80,假设合金中完全是金属铝,则n(Al3+)= n(Al(OH)3)=![]() mol,则溶解Al(OH)3所需要的n(OH-)=
mol,则溶解Al(OH)3所需要的n(OH-)=![]() mol,需要碱液的体积为
mol,需要碱液的体积为![]() mL,
mL,![]() =(80+
=(80+![]() )mL=
)mL=![]() mL,C选项错误;将关系图改为C图时,假设合金中完全是金属镁,则产生的沉淀不溶解,则
mL,C选项错误;将关系图改为C图时,假设合金中完全是金属镁,则产生的沉淀不溶解,则![]() =90,假设合金中完全是金属铝,根据反应:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,可以看出两个阶段消耗碱液的体积之比为3:1,则
=90,假设合金中完全是金属铝,根据反应:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,可以看出两个阶段消耗碱液的体积之比为3:1,则![]() =75,D选项正确。
=75,D选项正确。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?抚顺二模)把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
(2011?抚顺二模)把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a的取值范围为0≤a<50 | ||
B、
| ||
| C、若将关系图改为B图时,则a的取值范围为80<a<90 | ||
| D、若将关系图改为C图时,则a的取值范围为75<a<90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
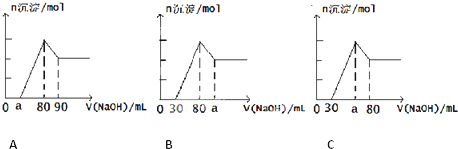
| A、A图中a的取值范围为0≤a<50 | ||
B、A图中
| ||
| C、若将关系图改为B图时,则a的取值范围为80<a<90 | ||
| D、若将关系图改为C图时,则a的取值范围为67.5<a<80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com