
(1)实验室中常用加热分解氯酸钾制取氧气,写出反应的化学方程式,并用双线桥法标出电子转移情况: 。
(2)实验室制取Cl2的反应方程式之一为: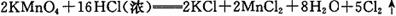 。
。
被氧化的盐酸占反应盐酸总量的 ;
当标准状况下有11.2L氯气生成时,该反应的电子转移数为 。
(3)已知下列两个氧化还原反应:O2+4HI===2I2+2H2O 及Na2S+I2===2NaI+S,则三种单质的氧化性顺序为:
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式: ;在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式: 。
(5)医疗上常用小苏打治疗胃酸过多,小苏打溶液与盐酸反应的离子方程式为: 。
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
下列叙述正确的是
A.同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等
B.任何条件下,等 物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等
物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等
C.同温同压下,1L一氧化碳气体一定比1L氧气的质量小
D.同温同压下的二氧化碳气体和氮气,若体积相等,则质量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L酒精含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+ 离子数为0.01 NA
C.11.2 L H2所含的电子数为NA
D.通常状况下,NA 个C O2分子含有原子数为3 NA
O2分子含有原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox )(3<x<4,
M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。
转化流程如图所示:
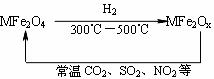
有关上述转化过程的下列叙述正确的是( )
A.  MFe2O4表现了还原性 B. MFe2Ox表现了还原性
MFe2O4表现了还原性 B. MFe2Ox表现了还原性
C. SO2和NO2表现了还原性 D. SO2和NO2发生了分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
 A.碳酸氢铵溶液与过量的氢氧化钠溶液反应 H+ + OH — H2O
A.碳酸氢铵溶液与过量的氢氧化钠溶液反应 H+ + OH — H2O
B.氢氧化铝与足量盐酸反应 Al(OH)3+3H+ ═ Al3++3H2O
 C.钠和冷水反 Na+2H2O N
C.钠和冷水反 Na+2H2O N a++H2↑+OH—
a++H2↑+OH—
 D.铜片与稀硝酸反应 Cu+NO3—+4H+ Cu2++NO↑+2H2O
D.铜片与稀硝酸反应 Cu+NO3—+4H+ Cu2++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或事实可用同一原理解释的是( )
A.浓硫酸和浓盐酸长期暴露在空气中 浓度降低
浓度降低
B.铁在冷的浓硫酸中和铝在冷的浓硝 酸中都没有明显变化
酸中都没有明显变化
C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色
D.漂白粉和水玻璃长期暴露在空气中变质
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2 LO2和O3组成的混合气体含有原子数为NA
B.常温常压下,1.7 g NH3含有的电子数目为 NA
C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA
D.常温常压下,22.4 LCO2与足量Na2O2反应转移电子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害.已知其相关性质如下表所示:
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |
| 白色结晶粉末 | 170~172°C | 易溶于水 |
(1)氯元素基态原子核外电子的成对电子数为 .
(2)氯吡苯脲的晶体类型为 ,所含第二周期元素第一电离能从大到小的顺序为 N .
(3)氯吡苯脲晶体中,氮原子的杂化轨道类型为 .
(4)氯吡苯脲晶体中,微粒间的作用力类型有 .
A.离子键 B.金属键 C.共价键 D.配位键 E.氢键
(5)氯吡苯脲熔点低,易溶于水的原因分别为
(6)查文献可知,可用2﹣氯﹣4﹣氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲.
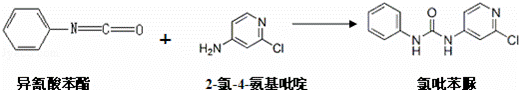
反应过程中,每生成1mol氯吡苯脲,断裂 个σ键、断裂 个π键.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com