
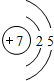 ,氮化硅中氮显-3价,硅显+4价,依据化合价代数和为0,可知氮化硅中氮原子数4个,硅原子数3个,化学式为:Si3N4;
,氮化硅中氮显-3价,硅显+4价,依据化合价代数和为0,可知氮化硅中氮原子数4个,硅原子数3个,化学式为:Si3N4;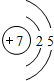 ;Si3N4;
;Si3N4;

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| A、都呈红褐色 |
| B、向Fe(OH)3胶体中滴加几滴浓盐酸,可能看到有沉淀产生 |
| C、利用滤纸过滤的方法可以分离两者 |
| D、微粒大小都在1~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水振荡,静置分层后用分液漏斗分离 |
| B、加NaOH溶液振荡后,静置分液 |
| C、加溴水振荡后,过滤 |
| D、加CCl4振荡后,静置分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Be2+中的电子数和质子数之比一定为1:2 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
D、Cl-的结构示意图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com