
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
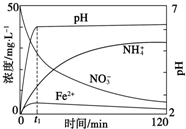 工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.15 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:NaOH>Mg(OH)2 | B. | 热稳定性:HCl>HBr | ||
| C. | 失电子能力:K>Na | D. | 原子半径:CI>S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
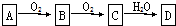
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子 | |
| B. | 1mol Fe参与反应失去电子数目一定为2NA | |
| C. | 金属钠和氧气反应制取过氧化钠,每生成1mol过氧化钠,转移电子数为4NA | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 大量氯气(溶于水显酸性)泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻,并迅速离开现场 | |
| C. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 | |
| D. | 实验室发生火灾时,应立即打开门窗呼救 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com